双功能脱氢酶通过形成高阶螺旋体结构来调节底物通道从而调节其酶活性
2020年波尔多大学的Rémi Fronzes团队在Nature communication上发表了关于双功能乙醛-乙醇脱氢酶(aldehyde-ethanol dehydrogenase, AdhE)形成的高阶螺旋体结构如何调控其双功能酶活性的文章。与2019年韩国高等科技学院的Ji-Joon Song团队在Nature communication上发表的同样关于AdhE高螺旋结构解析的工作相比,该团队进一步解释了其结构在双功能脱氢酶活性调节中潜在的调控机制。
众所周知,乙醛-乙醇脱氢酶酶(AdhE)是细菌生理和致病性的关键代谢酶,在厌氧环境下乙醇发酵过程中,它们通过形成乙醛这一中间体来将乙酰辅酶A转化为乙醇。 AdhE的结构主要是由 N-端乙醛脱氢酶 (Aldehyde dehydrogenase, AIDH) 和 C-端醇脱氢酶 (Alcohol dehydrogenase, ADH) 两个保守结构域通过Linker连接组成,分子量约为96kDa,且在ADH结构域中含有Fe2+(如图1)。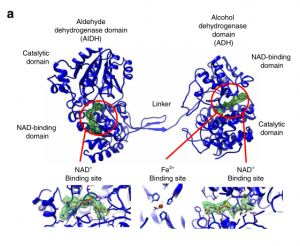
图1 双功能脱氢酶的功能结构域
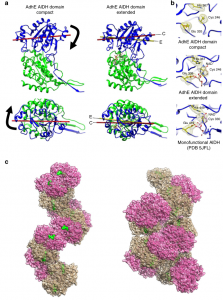
与2019年Ji-Joon团队的研究成果一致,作者发现AdhE可以寡聚形成螺旋体结构,且排列会受到辅因子(NAD+和Fe2+)的影响,但不受NADH的影响(如图2)。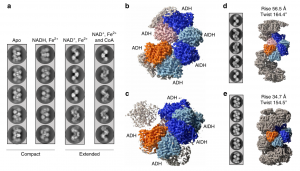
图2 冷冻电镜下不同构型AdhE螺旋体结构
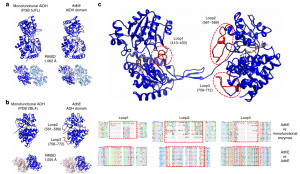
为进一步探究该螺旋体结构是如何调控乙醇-乙醛双能脱氢酶的活性,作者将其基因序列、蛋白质结构等信息与常见的单功能乙醇脱氢酶、乙醛脱氢酶进行了多重序列比对、蛋白晶体结构比较(如图3)。结果发现:在蛋白质结构上,AdhE与单功能酶相比多了3个Loop结构,命名为Loop1、2、3;序列上,AdhE与单功能酶相比存在明显的序列差异,且序列差异集中在Loop1、2、3结构对应的序列。同时,上述这三组差异序列在其他微生物来源的双功能脱氢酶AdhE中又是相对保守的。上述分析结果揭示了该Loop结构是潜在的调节AdhE多功能活性的结构。
图3 AdhE与单功能ADH和ALDH酶的结构比较
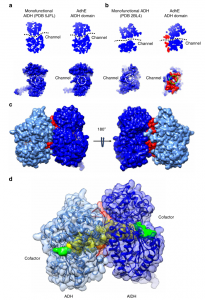
作者进一步比较了单功能酶与AdhE的通道结构发现,双功能酶AdhE在AIDH和ADH结构域中存在嵌入催化结构域和NAD+结合域之间的通道,且该通道可以直达两个酶的活性位点(如图 4)。
图4 通道直接连接adhα(浅蓝色)和aldhβ(蓝色)的活性位点。
基于上述的蛋白质序列、结构的解析,作者引入了辅酶NAD+,观察在该辅酶存在下蛋白质结构发生的变化。结果发现,当存在NAD+时,双功能脱氢酶AdhE中的AIDH结构域会向上摆动,使得其上一反应的中间产物更加快速的到达AIDH中进行下一步的反应,从而使得双功能脱氢酶构象处于最适合级联催化的构象(如图5)。
图5 AdhE紧凑态和伸长态之间的构象变化
综上所述,这项工作更加完整的展示了AdhE在辅酶因子NAD+存在与否的情况下形成的两种截然不同的高阶螺旋体结构,证明了螺旋体结构对维持其双功能活性的重要性,并且进一步阐述了潜在的调节机制。
参考文献:Filamentation of the bacterial bi-functional alcohol/aldehyde dehydrogenase AdhE is essential for substrate channeling and enzymatic regulation. 2020, Nature Communication.






buy metformin 1000mg for sale – order cozaar 50mg online acarbose 25mg cost
glyburide generic – buy forxiga 10mg online buy generic dapagliflozin for sale
purchase desloratadine sale – buy desloratadine 5mg sale order albuterol online
medrol 4mg otc – buy astelin nasal spray order generic azelastine 10ml
order asthma pills – buy theophylline 400mg generic buy theo-24 Cr 400 mg
order stromectol online – buy doxycycline no prescription cheap cefaclor
clindamycin pill – order oxytetracycline for sale purchase chloromycetin pills
azithromycin 500mg canada – flagyl cheap buy ciprofloxacin 500mg generic
amoxicillin buy online – cephalexin 125mg us cipro 500mg oral
buy generic augmentin over the counter – order ampicillin generic buy ciprofloxacin paypal
order atarax 25mg pill – order buspar 5mg pill order endep 25mg pills
generic quetiapine – order effexor 150mg without prescription purchase eskalith generic
anafranil pills – order sinequan 25mg generic buy sinequan 25mg pills
zidovudine 300 mg pills – allopurinol for sale buy zyloprim online
clozapine ca – buy amaryl pills buy famotidine for sale
glycomet 1000mg cheap – order baycip generic lincomycin 500mg tablet
order furosemide 40mg online – lasix 100mg without prescription brand captopril
flagyl 400mg us – purchase terramycin generic order zithromax 250mg generic
buy ampicillin pill cheap amoxicillin sale purchase amoxicillin sale
valtrex 500mg ca – buy generic valtrex cost acyclovir 800mg
order generic flagyl 200mg – order metronidazole 400mg pills order azithromycin pills
buy ciplox pill – buy erythromycin without prescription buy erythromycin online cheap
buy ciprofloxacin 500mg online cheap – order baycip for sale purchase amoxiclav generic
cheap cipro 1000mg – cephalexin 500mg tablet order augmentin 1000mg pill
buy atorvastatin for sale atorvastatin 80mg drug buy atorvastatin 40mg