新型冠状病毒的特征
在具体介绍检测方法之前,有必要介绍下病毒本身。新型冠状病毒,世界卫生组织(WHO)最近将其命名为SARS-CoV-2,旧称2019-nCoV,其导致的疾病称为COVID-19,当然,关于其命名,仍有争议,最后的定名需要国际病毒分类委员会开会正式决定(可能在今年6月)。本文中暂且仍称为SARS-CoV-2,中文名仍然是新型冠状病毒。
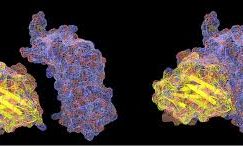
新型冠状病毒属于β属冠状病毒,有包膜,外形如下图(直径60-140 nm)。其遗传物质是单条正义RNA链,接近3万个碱基的长度。与SARSr-CoV和MERSr-CoV同属于同一家族,目前最接近的是蝙蝠SARS样冠状病毒(bat-SL-CoVZC45),有85%以上的同源性。
新型冠状病毒的RNA核心外,由蛋白质外壳包裹,表面突出的是刺突蛋白(S Protein),它是侵染宿主细胞关键。前天(2月20日),《科学》杂志发文,科学家利用冷冻电镜技术解析了刺突蛋白的分子结构,并发现它跟SARS病毒一样,与人体细胞的ACE2受体作用从而入侵细胞。但它与ACE2的亲和力是SARS病毒的10~20倍,这很可能是导致高度传染性的原因。
新型冠状病毒检测方法
100多年前,还没有病原体检测这一说法,因为当时对于微生物,特别是病毒还知之甚少。第一次发现病毒是在19世纪末,伊万诺夫斯基(D. Iwanowski)推测了烟草花叶病毒的存在,而直到20世纪40年代,电子显微镜的发明才使得人类看到了它。
对于细菌和疾病之间的科学验证方法,是德国科学家科赫(Robert Koch)在1890年提出的科赫法则,当然这一法则也同样适用于病毒。大致过程是这样的,可从得病宿主身上体外纯培养病原微生物,这种纯培养微生物能感染新的健康宿主,且发生同样疾病,并能再次分离出该微生物。虽然这一法则在一定情况下仍然适用于临床诊断,但对于快速检测病原体的需求来说,显然需要其他确诊办法。
现代最常用的病原体快速检测技术主要是两大类,一类是核酸的检测,另一类是抗原抗体的检测。核酸(DNA或RNA)是病毒的遗传物质,任何物种都有独一无二的核酸序列,那么对它特征序列的检测即可确定病原体。抗原是能激发人免疫反应产生抗体的任何物质,比如病毒的特征蛋白质是抗原,而人体免疫系统产生用来专门对抗该抗原的另外一种蛋白质就是它对应的抗体。这一组抗原抗体可以特异性相互结合的特性可以作为检测的理论基础。
新冠病毒的检测也无非是这两大类,那么下面对这些方法做个简要介绍和对比。
核酸
1. 测序
测序技术可直接解读出核酸碱基的排列顺序,DNA是ATGC、RNA则为AUGC的顺序,新冠病毒接近3万个碱基,比人类少多了,人基因组差不多是30亿。对于一个完全未知的新病毒来说,测序技术是必须的。但通常来说,对病毒的全部序列测序需要相对昂贵的仪器、较长的时间,且需要专业生物信息学人对其解读。
测序技术虽然早在1977年就已发明,但在“人类基因组计划”的末期(20世纪末),该技术瓶颈得到重要突破,并开始迅猛发展。据了解,2003年SARS的鉴定耗时5个多月、2013年H7N9为1个多月,而对新冠病毒的全基因组测序仅仅5天。
现在有少数企业已研制出新型冠状病毒核酸测序试剂盒的生产,比如,杭州杰毅生物、达安基因等。小编认为,仪器成本等各方面要求太高,测序技术还不适用于大规模检测用,但前景可期。
2. PCR
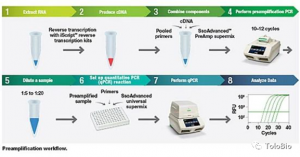
PCR(聚合酶链式反应)技术发明于1983年,这一体外扩增核酸序列的技术在当今几乎任何一个分子生物学实验都会用到。PCR拓展了各种应用,包括目的核酸的扩增、DNA片段的连接、突变等,以及这里重点介绍的检测。PCR技术应用之前,首先得要知道病原体的基因序列,找到它的特征序列,设计引物。然后,用变温的方式将双链打开、引物结合、延伸,经30个左右的温度循环,可使目的片段得到指数级的扩增。那么,反推可知,能检测到大量DNA目的片段的即是阳性样品。(当然,RNA样品需要逆转录酶转换成DNA)。DNA扩增产物验证可通过琼脂糖凝胶电泳验证,但这种操作一是麻烦、二是开盖容易造成产物的气溶胶污染。目前,也可以荧光物质、或荧光探针杂交法检测扩增产物。
第二代PCR技术是目前新冠病毒检测方法的主流方法。它在反应体系中加入了荧光物质,通过专门的仪器,可实现实时荧光检测,方便了结果读取过程,也防止开盖后造成可能的污染,该技术也可对模板进行定量计算。另外,为了增加灵敏度和特异性,该技术还有不少改进版本,比如Taqman探针法、双重或多重荧光PCR等。这一方法,是目前官方的测定方法。国内根据此方法研发试剂盒的公司也是最多的,已经多达数百家,不过呢,过审批的只有7家(后文还会进一步探讨)。
第三代PCR是数字PCR技术,它将一小管(50微升左右)分割成了近10万个液滴,单一液滴为独立的反应单元,反应完成后读取每一单元的扩增情况(荧光),从而最终可实现模板DNA的绝对定量。现在这样技术试剂和机器相当昂贵(一台仪器近百万元),对新型冠状病毒快速检测的优势不大。不过国内也有几家公司开发了基于此的试剂盒。
图片来自biorad公司
3. 等温扩增
PCR技术需要快速精准的升降温过程仪器,这类仪器相对昂贵,而等温扩增技术仅使用一个温度,对仪器的要求很低。等温扩增的方法有多种,但总的来说,这些技术主要分为2大类,一类是利用特殊的酶取代了PCR中高温解链的步骤,比如LAMP技术中的链置换DNA聚合酶和RPA中的重组酶、单链结合蛋白和链置换酶;另一类涉及到DNA和RNA之间的相互转换来扩增,比如NASBA和TMA用到的逆转录酶和RNA聚合酶。
小编总结了常见的几种等温扩增方法(见下表,不完全统计)。等温技术灵敏度和反应时间上,并不输给PCR。但等温扩增也有问题,首先是对引物的设计要求比较高,比如开发LAMP技术的日本荣研公司开发了专门设计LAMP引物的软件以应对复杂的设计,即使是这样,扩增的序列也不是任何区域都能设计得出来,而且实际效果要反复测试。另外,像RPA这种方法,较低温下的扩增反应,引物的非特异性结合的可能性会增加,容易造成假阳性。
此前,发明LAMP的日本荣研公司将其技术应用于结核分枝杆菌(TB)的检测,得到了WHO的认可和推荐,最近该公司也在全力研发对新冠病毒检测的试剂盒。在国内,杭州优思达在等温扩增的技术上也是领先的,其技术为交叉引物恒温扩增技术。其原理关键同样是链置换酶,只是引物设计策略与LAMP不同。此前,小编参观过该公司,从取样到出结果的一体化快速检测耗材与仪器是它的优势。最近,也被国家列为新冠病毒快速检测的紧急审批9个产品之一。
4. CRISPR检测技术
CRISPR技术的广泛为众人知晓,是它在基因编辑领域的叱咤风云。实际上,CRISPR也可用于检测,最初是2017年由张锋团队开发的基于CRISPR-Cas13的检测RNA的技术,称为SHERLOCK(Specific High sensitivity Enzymatic Reporter unLOCKing),该方法原理是Cas13蛋白在人工设计的gRNA引导下,结合特异性RNA序列后,产生反式切割RNA探针的活性。而后不久,小编在内的中科院和吐露港公司开发了基于 CRISPR-Cas12的技术,注册专利并发文,命名为HOLMES(one-HOur Low-cost Multipurpose highly Efficient System),它专用于检测特异性DNA。当然,DNA和RNA之间很容易实现相互转换,因此这两个技术对于DNA和RNA都可检测。该技术被《科学》誉为下一代分子诊断技术。
需要指出的是,单独使用CRISPR检测技术通常达不到临床检验的灵敏度,因此需要结合扩增技术来提高灵敏度。CRISPR检测技术理论上可进一步提高单独使用扩增方法的灵敏度和特异性。目前,张锋等人公开了新冠病毒的CRISPR检测法(结合RPA扩增和试纸条)。
在国内也有几家公司开发了基于CRISPR的检测技术,包括吐露港和华大合作的CRISPR法检测仪。但这些都还需要临床样本的实际效果检验。得提一句,Doudna等人也发表了基于Cas12的山寨版检测方法,称为DETECTR(DNA endonuclease-targeted CRISPR trans reporter)。值得高兴的是,就在最近,吐露港公司和张锋团队达成了协议,实现专利互享。
抗原抗体
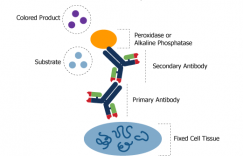
对于人们熟悉的试纸检测(1条红线阴性,2条红线阳性),大多数都是基于抗原抗体的胶体金原理。新型冠状病毒的检测也可作为试纸条来检测。
比如,新型冠状病毒表面带有多种结构蛋白,这些蛋白包括多个抗原表位,利用抗原与抗体特异性结合的原理,可通过抗体检测抗原的存在,从而直接证明样本中含有新型冠状病毒。
除了直接测病毒抗原,另一种方法是测血液中人体内产生的抗体。在病毒感染人体后,刺激免疫细胞产生特异性抗体,同样利用抗原与抗体特异性结合的原理,可通过抗原检测抗体的存在,从而间接证明人体已感染新型冠状病毒。检测的抗体主要分为IgM和IgG两类。目前对新型冠状病毒的这两类抗体的产生和持续时间还没有系统性研究,不过通常情况下,符合下图的规律。IgM抗体产生早,一经感染,快速产生,维持时间短,消失快,血液中检测阳性可作为早期感染的指标。IgG抗体产生晚,维持时间长,消失慢,血液中检测阳性可作为感染和既往感染的指标。
该方法检测只需十几分钟,无需特殊仪器,但目前灵敏度和特异性有限,同时几乎无法检测潜伏期和感染初期的病人,因此不能作为新冠肺炎确诊和排除的唯一依据。抗体检测容易受到血液标本中的一些干扰物质(如类风湿因子、非特异IgM、溶血所致的高浓度血红蛋白等)的存在而出现“假阳性”结果,所以抗体检测必须采用IgM和IgG同时检测且通常需多次动态检测来确认。
检测方法比较
1. 时间
据报导,对SARS-CoV-2进行体外培养时,需96个小时左右才可在人呼吸道上皮细胞内发现,显然用于快速检测不现实。对于快速检测来说,当然是越快越好,能实现实时检测是最佳的(比如发烧可用红外测温仪实时监测)。不过,就目前的技术来说,最常用荧光PCR法核酸检测大约2-4小时;等温扩增法和结合CRISPR的等温扩增可以实现1小时以内的检测,但其真正临床样本的有效性还需进一步验证。抗原抗体法用试纸大约15分钟左右。抗原抗体法虽然方便、检测快,但目前不能作为确诊的唯一标准。
2. 操作难度
步骤复杂,只有科学家会做的实验步骤绝不是好方法。目前最常用的检测方法,RT-PCR试剂盒产商也不断的对操作步骤简化,有些步骤也已有自动化仪器代替人工。操作步骤的简化不仅减少了检测时间,降低操作人员的操作失误和实验误差。就核酸检测法来说,文中提到的方法理论上都可实现全自动化,但目前平台的价格和一体化上还有很大的优化空间。
3. 灵敏度
灵敏度是检验要求中非常重要的指标。终极追求的是1个分子的病毒核酸能检测到,但不管哪种方法都几乎是不可能的。不过在科研条件下,上述4种方法都已经有报道达到分子级别的灵敏度(10分子以内),然而临床检测的要求更高,需要稳定的灵敏度。因此,考验生产厂商的不是技术本身,而是试剂的稳定性、合适的各试剂配比、引物序列设计的合理性、引物纯度、抗杂质干扰能力等等。目前国家药监局的分析灵敏度要求是300拷贝/毫升以下。
4. 价格
这包括所需环境价格(比如必须在专业实验室)、仪器价格,试剂耗材价格,人员培训费、人工操作费等。小编认为,这跟药物、疫苗的开发一样,商业利益和人道主义有共同的目标,但也有冲突的地方。商业利益追求更高的收益、更大的市场,所以说,他们看不上几块钱试纸条,而追求一台百万元级别的数字PCR和测序仪。从药物研究上也可看出,涉及老年慢性疾病研究和投入是最多的,而SARS的药物和疫苗研究几乎就没什么进展。如果说解决的办法,我想可能更多需要国家和公益机构投入更多资金(比尔盖茨和梅琳达基金会是很好的榜样)。
5. 准确度和特异性
准确度和特异性是非常重要的检测指标,官方要求快速检测试剂盒准确度不低于99%,涵盖因变异导致的检测假阴性。简单地说,真感染病毒的人没检测出来,是假阴性;而没感染病毒的人测出病毒,是假阳性。造成假阴阳性的原因很多,例如,采样方法和质量、样品杂质、样品保存、试剂盒产品稳定性、人员操作失误等。如果单从技术方法来看,除昂贵的测序之外,目前第二代实时荧光定量PCR技术相对是最佳的。






buy rybelsus 14mg generic – semaglutide 14mg usa desmopressin order online
buy terbinafine 250mg online – griseofulvin generic buy generic griseofulvin
prandin without prescription – cheap empagliflozin purchase jardiance sale
buy generic micronase – buy dapagliflozin 10mg without prescription purchase dapagliflozin sale
MQLmugTnICtwfUO
rWvdOAhxKIaSfQXU
Wow, awesome blog format! How lengthy have you ever
been blogging for? you make blogging glance easy. The full
look of your site is excellent, as neatly as the content!
You can see similar here sklep internetowy
purchase clarinex – albuterol 2mg us ventolin 2mg ca
price of stromectol – aczone order online buy cefaclor without a prescription
order albuterol online – pill theo-24 Cr 400mg buy theophylline 400mg sale
azithromycin over the counter – zithromax 500mg over the counter order ciplox pills
cleocin 300mg without prescription – buy cleocin without prescription chloromycetin online buy
buy augmentin online cheap – buy ampicillin without prescription cipro usa
amoxil brand – buy amoxicillin for sale buy ciprofloxacin 1000mg generic
oral clomipramine 25mg – paxil 10mg tablet buy generic doxepin online
order generic atarax 10mg – buy lexapro 20mg online buy amitriptyline without a prescription
brand quetiapine 50mg – buy generic bupropion online buy eskalith sale
order clozaril 100mg pills – buy clozapine 100mg generic famotidine ca
buy glycomet tablets – order metformin 1000mg online lincocin cheap
order retrovir 300mg generic – buy generic avapro 300mg buy allopurinol 100mg pill
ampicillin tablet penicillin price order amoxicillin online cheap
furosemide 100mg tablet – purchase furosemide without prescription purchase capoten without prescription
flagyl for sale online – oxytetracycline 250 mg cost buy generic zithromax
ivermectin 3mg over counter – order sumycin tetracycline 500mg oral
buy valacyclovir 1000mg generic – buy nemasole for sale buy generic zovirax over the counter
ciprofloxacin 500mg oral – order tindamax 500mg without prescription erythromycin 500mg sale
order flagyl online – purchase flagyl generic order zithromax 250mg sale
ciprofloxacin where to buy – cheap bactrim 960mg cost augmentin 1000mg
ciprofloxacin tablet – order keflex 500mg generic buy generic clavulanate
generic lipitor 80mg lipitor 20mg brand atorvastatin canada