2021年1月,中国科学院微生物研究所的吴边团队在ACS Catalysis上发表文章提出了一种新型蛋白质稳定性计算设计策略——GRAPE(greedy accumulated strategy for protein engineering)(图1),利用该策略研究人员对PET塑料降解酶IsPETase进行了稳定性改造,使得突变体DuraPETase的熔融温度升高31℃,并且在温和温度下对PET膜的降解增强30%(图3A)。还实现了在温和条件下将2 g/L微塑料完全生物降解为水溶性产品(图3E)。
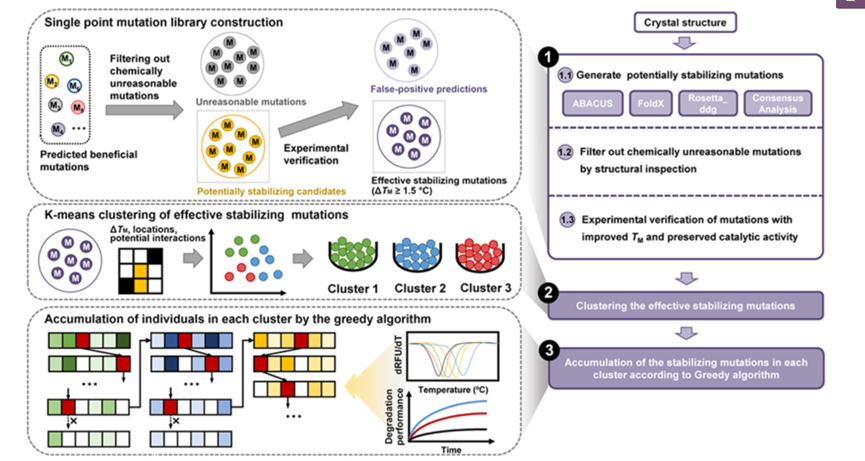
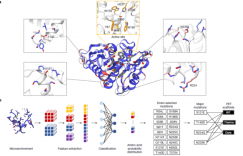
图1. GRAPE 策略示意图
GRAPE策略主要分为3个部分
1、基于四种不同的单点突变预测算法ABACUS、FoldX、Rosetta –ddg、 Consensus Analysis预测到253个潜在位点,经过人工检查筛选(破坏氢键、疏水残基暴露等)和实验验证最终获得了21个有益单点突变;
2、通过K-means聚类算法,将21个有益单点突变分为3个Cluster;
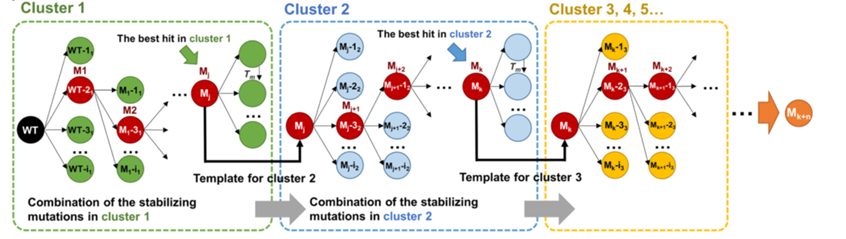
3、组合阶段根据热稳定性和降解性能来决定是有益突变还是有害突变,根据贪婪算法(图2)对每个聚类中的突变进行累积,以识别出稳定性和酶活性提高的多点组合突变。值得注意的是,贪婪算法不从整体最优上加以考虑,算法得到的是某种意义上的局部最优解。
图2.贪婪算法示意图
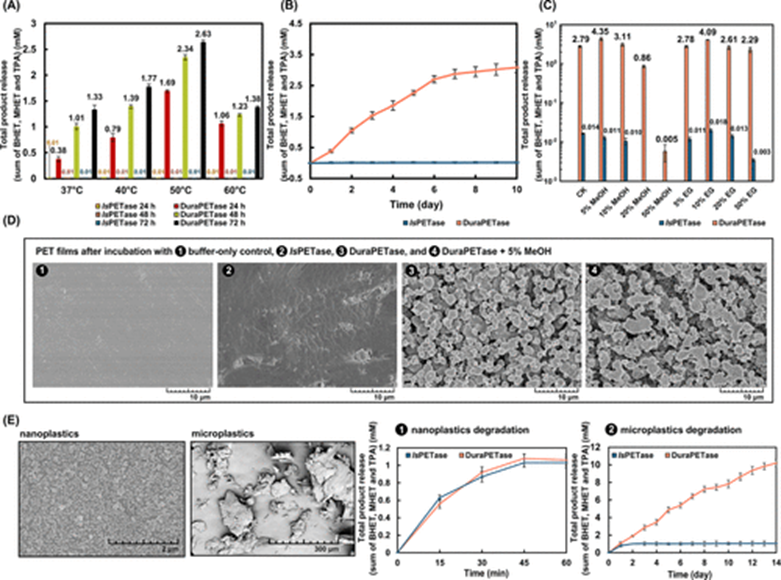
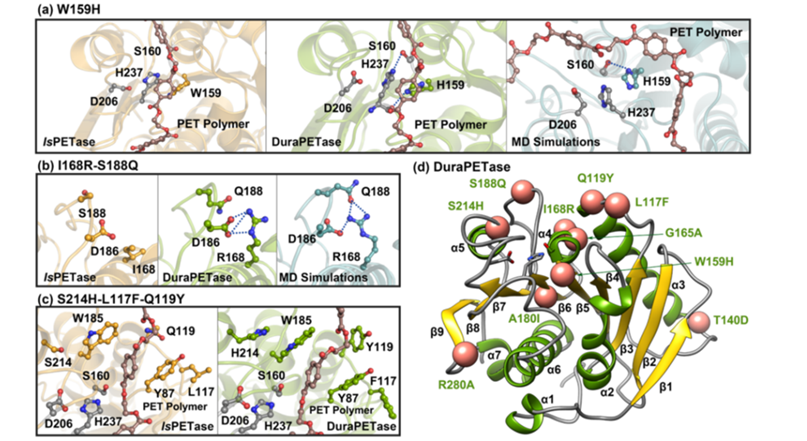
经过10轮迭代叠加得到突变体IsPETase-M10(S214H-I168R-W159H-S188Q-R280A-A180I-G165A-Q119Y-L117F-T140D, M10),研究人员将其命名为DuraPETase,并对其进行了活性检测、扫描电镜分析和蛋白晶体结构解析。结果显示,DuraPETase对30%结晶度PET薄膜的降解效率相较于野生型提升了300倍(图3B),对甲醇和乙二醇的耐受性显著提高(图3C);经DuraPETase处理后的PET薄膜内部结构发生了显著的腐蚀变化(图3D);在动力学模拟中观察到W159H突变与Ser160形成一个新的氢键(图4a),I168R和D186之间形成新的盐桥相互作用(图4b),L117F和Q119Y与Tyr87形成了“T形” π-π 相互作用(图4c)。
图3(A)DuraPETase相较于野生型 Is PETase在不同温度下对30%结晶度PET薄膜的降解性能;(B)DuraPETase及野生型 I s PETase在37°C条件下对30%结晶度PET薄膜的降解曲线;(C)DuraPETase及野生型 Is PETase在有机溶剂中的降解性能;(D)PET薄膜在不同溶剂中孵育10天的扫描电镜图;(E)DuraPETase及野生型 Is PETase对纳米塑料及微塑料的降解曲线。
图4 W159H,I168R-S188Q, S214H-L117F-Q119Y突变的结构分析
GRAPE策略的提出是酶设计方法的重大进步,其优势在于结合了聚类算法和贪婪算法,通过最少的实验筛选,在较短时间内最大限度的探索序列空间叠加路径。该研究为计算机辅助蛋白质改造提供了新思路,并为减少环境微塑料积聚的研究开辟了道路。近期,该团队已经开发了基于此策略的网站服务器,地址https://nmdc.cn/grape-web/,更方便广大研究人员的应用。
论文链接:https://pubs.acs.org/doi/full/10.1021/acscatal.0c05126







oJBSuFrnKXktcOCN
how to buy glyburide – cheap micronase 2.5mg buy forxiga no prescription
glucophage 1000mg pill – buy cheap acarbose cheap precose
order desloratadine 5mg generic – order aristocort generic order albuterol
how to get medrol without a prescription – cetirizine pill oral azelastine 10 ml
albuterol uk – order promethazine sale buy theo-24 Cr generic
buy generic cleocin – cost cefpodoxime 200mg purchase chloromycetin online cheap
azithromycin ca – metronidazole for sale buy ciplox 500mg generic
purchase amoxicillin – order erythromycin 500mg generic purchase baycip generic
augmentin 1000mg uk – order ethambutol 600mg brand ciprofloxacin 1000mg
atarax 25mg us – order fluoxetine 20mg generic cheap endep 25mg
quetiapine cheap – buy generic ziprasidone for sale order eskalith
clomipramine 50mg pills – imipramine generic doxepin 25mg canada
zidovudine generic – cheap allopurinol 300mg
generic clozapine – accupril where to buy famotidine us
buy metformin 1000mg – purchase lamivudine generic buy lincomycin paypal
order lasix 100mg pills – buy tacrolimus 1mg online order captopril generic
how to get flagyl without a prescription – cost cefaclor 250mg buy zithromax no prescription
buy ampicillin online order penicillin online cheap order generic amoxicillin
valtrex 500mg canada – buy valtrex medication buy zovirax pills
side effects of ivermectin – how to buy aczone buy sumycin 250mg online cheap
flagyl 400mg canada – azithromycin buy online order zithromax 500mg pills
ciprofloxacin 500mg over the counter – erythromycin 500mg ca erythromycin 500mg for sale
oral ciprofloxacin – keflex usa buy augmentin 375mg pills
cipro 500mg usa – buy cheap generic bactrim augmentin oral
atorvastatin 10mg ca purchase lipitor order lipitor 10mg pill
EtrsFnobLlaBQ