DOI: 10.1021/acscatal.9b00621
Tarek Shanati,Cameron Lockie,Lilian Beloti,Gideon Grogan,Marion B. Ansorge-Schumacher
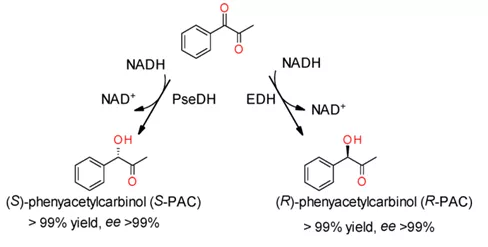
2019年5月,德累斯顿工业大学(TUD)的Marion Ansorge-Schumacher教授及其团队从Arthrobacter sp. TS-15 (DSM 32400)鉴定分离出属于短链脱氢酶/还原酶(SDR)超家族的两个麻黄碱脱氢酶——PseDH和EDH。其中,PseDH和EDH催化1-苯基-1,2-丙二酮(1a)不对称还原分别生成(S)-1-羟基-1-苯基丙酮((S)-phenylacetylcarbinol,(S)-PAC)和(R)-PAC(如图1)。
图1 脱氢酶对1a的不对称氧化还原反应
作者探究并阐述了PseDH和EDH的功能和结构特征,首先是蛋白功能研究,包括两个脱氢酶的立体选择性、底物特异性以及酶动力学常数、蛋白质稳定性 。
底物特异性实验表明,PseDH和EDH能将多种芳基脂肪族羰基化合物(包括酮胺、酮酯和卤代酮)还原成相应的对映体醇;pH稳定性实验表明,PseDH和EDH分别在pH6.0−8.0和7.5−8.5范围内稳定性最好;热稳定性结果显示,在25℃时,PseDH比EDH更稳定,然而当温度升高至40℃时,EDH更稳定,其半衰期是25°C时的2倍。
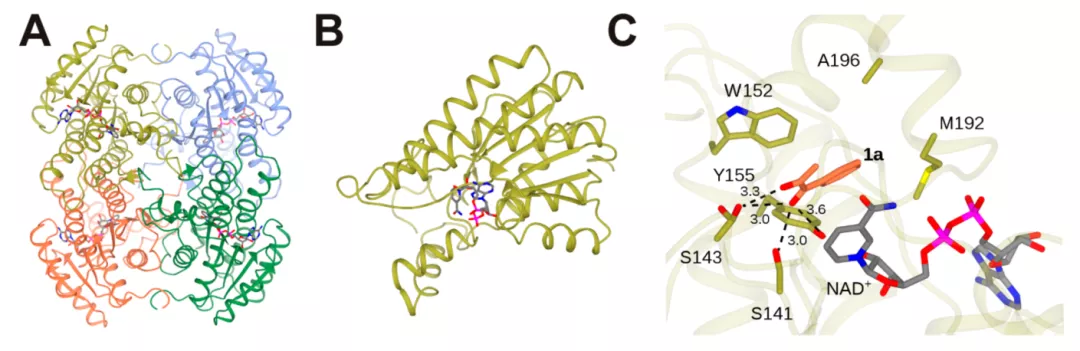
图2 PseDH晶体结构
尽管决定立体选择性的活性位点在PseDH和EDH中尚未确定,但是研究者发现Y155和S141是PseDH中的保守氨基酸,在EDH中S143和W152分别被A和Y取代。将PseDH和EDH及其他30个不同来源的ADH氨基酸序列进行比对,结果表明:PseDH的氨基酸序列与EDH和RasADH的同源性最高(分别为32%和31.5%),其中S143位常为小的疏水氨基酸如G、A或V,而W152位最常见的是H、M或L(图3)。因此,这两个位点的氨基酸残基在识别底物和定位还原反应中可能起关键作用。
图3 脱氢酶的多序列比对
新型脱氢酶PseDH和EDH是一种很有前途的绿色化学工具,它们优异的立体选择性和广泛的底物特异性为其在工业应用提供了光明的前景。此外,将提高PseDH和EDH稳定性作为新的研究起点,可进一步发挥其工业应用价值。
参考文献:
- Two Enantiocomplementary Ephedrine Dehydrogenases from Arthrobacter sp. TS-15 with Broad Substrate Specificity. DOI: 10.1021/acscatal.9b00621
- Critical residues for structure and catalysis in short-chain dehydrogenases/ reductases. DOI: 10.1074/jbc.M202160200







glyburide order – glyburide 2.5mg uk order forxiga for sale
oral desloratadine – albuterol online order albuterol 4mg pill
depo-medrol over the counter – astelin buy online buy astelin online cheap
order albuterol 2mg pills – promethazine online order buy theo-24 Cr 400 mg for sale
ivermectin 3mg pills – cheap aczone cefaclor 250mg canada
order cleocin 150mg online – purchase chloromycetin generic buy cheap generic chloramphenicol
azithromycin 250mg sale – order floxin generic ciprofloxacin cost
amoxil medication – cheap amoxil for sale order cipro for sale
buy generic augmentin 375mg – bactrim for sale order baycip online
order hydroxyzine 25mg pills – fluoxetine 40mg canada buy endep 25mg online
order quetiapine for sale – brand effexor eskalith over the counter
buy clozaril sale – oral frumil famotidine 40mg oral
retrovir brand – buy allopurinol pills
purchase metformin for sale – order generic cefadroxil buy lincocin online
RvLXHqcFJYIsht
order lasix 40mg – order captopril 25 mg online cheap buy generic captopril
metronidazole 200mg cheap – purchase cefaclor online order azithromycin 250mg generic
buy ampicillin pill penicillin cost order amoxil pills
how to buy valtrex – valtrex 1000mg us order acyclovir 400mg
ivermectin 6mg over counter – sumycin where to buy buy tetracycline generic
oral flagyl 400mg – buy amoxil no prescription azithromycin online order
buy ciprofloxacin generic – erythromycin 250mg pill buy erythromycin 250mg online
cipro 1000mg usa – buy ethambutol medication order amoxiclav for sale
ciprofloxacin 1000mg without prescription – order baycip without prescription order augmentin 625mg
atorvastatin uk atorvastatin 10mg brand lipitor 80mg pill
loUacsXK