小编:
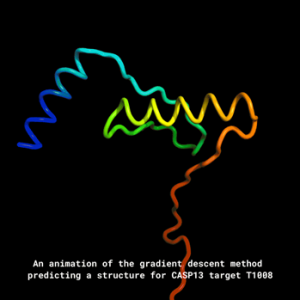
蛋白质的氨基酸序列即决定了它的空间结构,蛋白质空间结构是发挥活性的关键。这个概念早在上世纪六七十年代就被提出和广泛接受,甚至当时人们乐观地认为,从一级结构预测三维结构的时代即将到来。不幸的是,半个多世纪过去了,人们基本上还是依靠晶体衍射等实验得到蛋白质空间结构,而且非常重要(蛋白质结构的文章CNS(Cell,Nature,Science)总是源源不断)。人们从氨基酸序列预测蛋白质结构的能力没有明显提高,特别是没有已知结构同源的全新蛋白。当然最近,AlphaFold(https://deepmind.com/blog/alphafold/)的卓越表现让人们看到了希望。
这篇小评论从酶(一大类蛋白质)的定向进化出发,构想未来的化学反应,通过计算机辅助设计酶,即可催化完成各种自然界存在或不存在的反应呢?
原文:https://onlinelibrary.wiley.com/doi/full/10.1111/1751-7915.13345
2018年10月3日,加利福尼亚理工学院(美国帕萨迪纳)的Frances H. Arnold教授因其在定向进化方面的开创性工作,获得诺贝尔化学奖。她的核心学者,美国哥伦比亚密苏里大学的George P. Smith和剑桥(英国)MRC分子生物学实验室的Sir Gregory P. Winter开发了噬菌体展示技术,并使用这种方法进化抗体来增强结合特性。Arnold意识到,Smith和Winter可能让人相信她的工作主要集中在医疗应用上。然而,诺贝尔委员会列出了奖励缘由:“用于酶的定向进化”。酶,自然界的催化剂,对于分子转化至关重要,并且从根本上改变 – 甚至创造 – 催化功能的能力,生物经济真正出现的关键在于它建立在可再生性和可持续性原则基础上的。
“生物”是一位非常了不起的化学家,这已经不是什么秘密了。天然产物作为治疗剂的丰富历史提供了充分的证据,证明酶具有破坏和制造化学键的能力,最终形成复杂的结构,例如抗生素和抗真菌剂中发现的那些已被证明对人类健康和发育必不可少的结构。虽然许多这些分子可通过合成有机化学获得,但大多数实际上并非如此。也就是说,大量的反应步骤和低的化学合成总收率使得发酵成为优选的生产方法。除天然产品外,其他生物化学品通过发酵在商业上有效生产,包括各种氨基酸,柠檬酸和乳酸,当然还有传统用乙醇。在某些情况下,比如乙醇,少量操作微生物宿主即可实现可接受的生产指标,工艺设计是系统的唯一工程输入。在其他情况下,代谢工程开始发挥作用,通过这种方法改造生物体(通常是微生物)以增加产品滴度(即浓度),速率(即生产力,以每次浓度为单位)和产量(即可用底物的比例转换为目标产品)。然而,所有这些分子都有一个共同点:它们都是通过已建立的生物合成途径自然形成的。
这是否意味着只有那些首先被鉴定为天然生物代谢物的化合物才适合基于发酵的化学合成方法?当然不是 – 那太无聊了!多年来,酶学家已经知道,生物催化剂不符合之前生物化学课程中常见的一个锁/一个钥匙模型(one‐lock/one‐key model)。利用这种知识通过单步反应可产生许多分子,可能最显著的是在药物的合成中。酶的可塑性也已经在完整的代谢途径中利用,从而能够设计新的生物合成途径。然而,在许多情况下,当在非天然底物上工作时酶的催化活性太低而不能实际使用。进入定向酶进化时代就不同了!计算蛋白质设计,甚至能够创建在自然界中不存在的酶。也许,毫不奇怪,这些酶经常表现很差。怎么做才能让它们更强大,更快,更好?定向进化!直接进行进化还能够构建另一种酶,该酶可以进行自然界中未发现的反应,一种在碳和硅之间形成键的物质,两种地球上丰富的元素。
总而言之,这些技术进步已经实现了什么,以及那些即将出现的技术进步?未来的工业化学家可能会将微生物细胞视为默认的反应容器。她可以决定她想要生产什么样的分子 – 一种可能是一种有前途的抗人类疾病的新疗法,或者可以提供具有净中性碳足迹的可生物降解材料。她在软件的图形用户界面中绘制了结构,该软件将转向和搅拌并吐出几种可能的合成路线,所有这些都从简单的碳源如葡萄糖,甘油或木糖开始。(当然,她使用电子笔绘制结构,立即清理和复制完美定位的键长和角度。由算法产生的路线呈现逐步的生物合成方案,其通过推荐用于执行每个反应的特定酶来增强。该算法将每种酶的已知底物与提出的底物进行比较,并对推荐值进行排序。随后通过考虑每个单独步骤的可行性以及途径的热力学来对整个途径进行排序。如果没有已知的酶,算法建议从头合成(de novo)支架设计,以创造所需的酶活性。当化学家选择她的顶部通道(或两个或三个)时,她将选择推到生物组织中,其中基因被合成并组装成表达构建体(以免我们忘记了我们的启动子,核糖体结合位点和终止子),然后被引入少数宿主生物体。编码每种酶的遗传构建体可以一次引入和测试一次,或者,幸运的是,她可能决定立即去本垒打。不幸的是,她不太可能发现一种设计以正确的滴度、速率和产量生产目标化合物,但她既不失望也不沮丧。她知道进化就在她身边。她创造了一种可以轻松检测目标分子的生物传感器,无论是中间产品还是最终产品,并开始几轮定向进化中的第一轮。从每一轮中汲取的经验教训,结合有前景变体的晶体结构的见解,为迭代设计过程提供了依据。使用来自合成生物学的设计 – 测试 – 构建 – 学习循环的其他工具,而不是用于构建和操纵微生物菌株的少量机器人平台,只需要几个月的时间才达到目的。她早早地完成了庆祝下午的放松,她开始思考下一个项目,想知道化学作为生物学的真正限制在哪里设计。
小知识:
“关于氨基酸序列与蛋白质空间结构的关系研究最早的工作是由C.Anfinsen (1960)关于核糖核酸酶的研究工作。他研究了核糖核酸酶的去折叠和重折叠过程。该酶是由124 个氨基酸组成的蛋白质,有四对二硫键,其组合有105{[(2×4)!/24×4!]=105}种的可能方式。当用还原剂如β-巯基乙醇(HOCH2-CH2-SH)作用时,二硫键被部分还原。继续加大b-巯基乙醇的量,二硫键可全部被还原。用8 M的脲加β-巯基乙醇处理多肽链,分子内四对二硫键可全部被还原,肽链伸展为无规卷曲,酶活性完全丧失。但如果将脲和b-巯基乙醇透析掉并在空气中进行氧化,多肽链可又重新折叠为一个具有特定的三维结构和催化活性的酶,它与未经处理的酶具有相同的溶解度并可结晶并获得相同的X-射线衍射图,其吸收光谱也相同。这是一个很好的蛋白质一级结构序列决定其三维结构的例子,即顺序决定构象。Anfinsen因此而获得1972年诺贝尔化学奖。”
“通过一系列精心设计的RNase A实验,Anfinsen证明了蛋白质可以自发地折叠成它们地天然结构,而不需要其他任何试剂的介入,因此蛋白质的折叠在某种程度上就编码在氨基酸序列中。另一方面,Levinthal指出即使是很小的蛋白质,它可能的结构数目也如天文数字一般,因此寻找其正确结构的过程不能是随机搜索所有的可能性,因此探究蛋白质序列如何编码三维结构,以及理解该结构如何折叠就成了多年来一个很有科学价值的问题”
--《生物信息学,Westhead,D.R等著》





where to buy micronase without a prescription – order glucotrol 5mg pill how to get dapagliflozin without a prescription
desloratadine order – purchase clarinex sale order albuterol sale
albuterol 4mg cheap – order albuterol 4mg generic buy cheap theophylline
ivermectin without a doctor prescription – where can i buy eryc cefaclor 250mg for sale
brand cleocin 300mg – oxytetracycline generic chloramphenicol generic
buy zithromax 500mg pills – buy sumycin generic ciplox 500 mg us
generic amoxicillin – generic amoxil order ciprofloxacin 1000mg sale
buy augmentin generic – order amoxiclav sale cipro for sale online
hydroxyzine 10mg brand – prozac us buy endep 25mg sale
order anafranil sale – buy abilify pill doxepin drug
order quetiapine pill – quetiapine 100mg tablet order eskalith sale
buy clozaril 100mg pills – clozaril usa generic famotidine
glycomet pill – metformin price buy lincomycin 500mg generic
order lasix 100mg pill – order furosemide sale buy generic capoten over the counter
flagyl 400mg price – purchase cleocin sale azithromycin 500mg drug
ampicillin oral penicillin medication cheap amoxil sale
buy valtrex sale – nemasole cheap acyclovir pills
buy oral ivermectin – order suprax 200mg online cheap tetracycline cost
flagyl oral – buy cleocin online cheap buy generic azithromycin 250mg
buy generic ciprofloxacin for sale – order tindamax 300mg generic erythromycin 250mg over the counter
buy ciprofloxacin paypal – where can i buy bactrim augmentin order
order generic baycip – buy bactrim 480mg amoxiclav cost
atorvastatin oral order lipitor 10mg generic atorvastatin