文章链接:https://www.nature.com/articles/s41467-020-16898-y
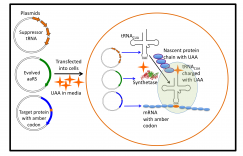
正交氨酰基-tRNA合成酶/tRNA 对是定点引入非天然氨基酸的关键先决条件。由于其高密码子抑制效率和完全正交性,吡咯赖氨酰-tRNA合成酶/吡咯赖氨酰-tRNA对是目前真核生物和原核生物遗传密码扩展的理想系统。因而迫切地需要发现或设计其他完全正交的翻译系统。本文创建了多个嵌合tRNA合成酶/嵌合tRNA对,包括嵌合组氨酸、苯丙氨酸和丙氨酸系统。作者进一步表明,这些嵌合系统是正交且高效的,具有与吡咯赖氨酸系统相当的活性。此外,嵌合苯丙氨酸系统可以在大肠杆菌和哺乳动物细胞中引入一组苯丙氨酸、酪氨酸和色氨酸类似物。这些芳香族氨基酸类似物表现出独特的性质和特征,包括荧光、翻译后修饰。
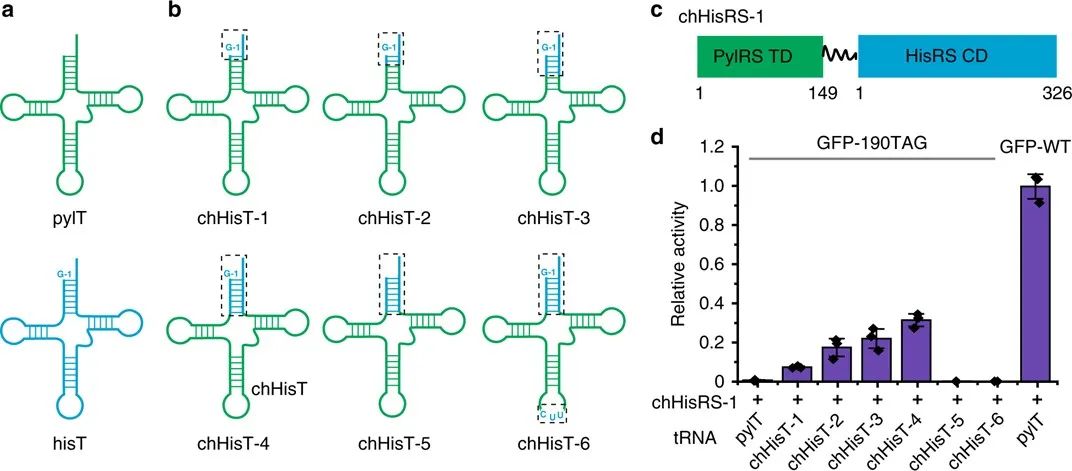
在上图可以看到pylRS/pylT对的结构示意图(左图),常见的aaRS/tRNA对的结构示意图(右图),融合pylRS tRNA结合域(TD) 和aaRS 催化域(CD) 的嵌合aaRS (chRS) 结构示意图,嵌合 tRNA (chT) 是通过用给定 tRNA的受体臂(acceptor arm)替换pylT受体臂(中间图)。下图为文中用到的天然氨基酸以及非天然氨基酸的结构图。
HisRS有两个独立的区域,一个CD和一个TD,它们由一个短肽接头连接起来。hisRS 中CD和TD之间的明显差异促进了在不影响CD催化活性的前提下,pylRS TD和hisRSCD融合蛋白的设计。HisT(His tRNA)有一个不常见的G−1碱基,这对其与hisRS催化域的结合非常重要。作者以pylT(pyl tRNA)为模板,用hisT的受体臂部分碱基对替换pylT受体臂相应部分,进而得到一系列chHisTs。接下来,将pylRSTD与HisRS CD融合构建嵌合体HisRS(chHisRS-1)。总之,作者构建了一系列具有不同受体臂的chHisTs结构以及 chHisRS-1,通过GFP报告基因分析来研究琥珀密码子抑制效率。结果表明,携带整个hisT受体臂的chHisT-4表现出最高的琥珀密码子抑制效率,与相同表达条件下,实现了与野生型 GFP相比35%的GFP表达量。尤其重要的是,chHisT-4的琥珀抑制效率比chHisT-1到chHisT-3要高许多。
为了进一步提高嵌合组氨酸系统的引入效率,作者随后设计了一系列chHisRSs,方法是通过将pylRS TD或其突变形式 (IPYE突变体) 与HisRS CD在N端或C端融合。
琥珀抑制效率结果表明,在chHisT存在的情况下,chHisRS-2或chHisRS-4与野生型 GFP 相比,检测到近60%的GFP表达量。chHisRS-2和chHisRS-4均含有pylRS TD(IPYE 突变体),这与之前的报道的pylRSTD上的IPYE突变能提高吡咯赖氨酸系统琥珀抑制效果的结论一致。作者还观察到,与相应的C端融合相比,在N端融合处具有pylRS TD的chHisRS通常能更显著地提高琥珀抑制效率。此外,作者通过LC-MS证实,嵌合组氨酸对引入His 时的误引率很低。接下来,作者研究了嵌合组氨酸系统在真核细胞中的功能,在chHisT和chHisRS的存在下清楚地观察到GFP的表达,其表达量与引入BocK 的PylRS系统相当。
3.嵌合组氨酸系统的正交性
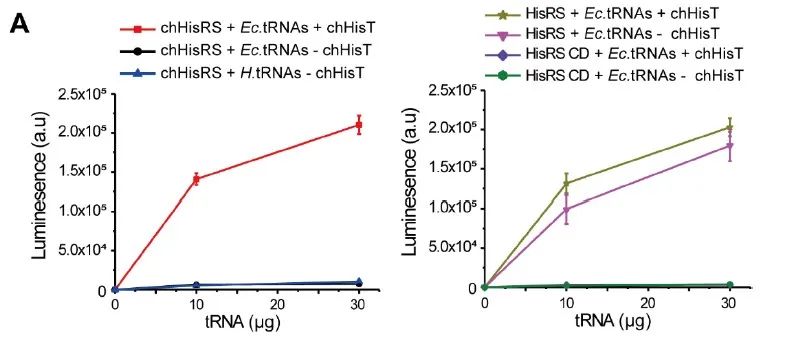
为了进一步证实chHisRS的正交性,作者进行了体外氨酰化实验并测试了chHisRS与来自大肠杆菌细胞和哺乳动物细胞的所有内源性 tRNA 的正交性。以大肠杆菌 HisRS 作为阳性对照,单独使用其催化结构域(hisRS CD)作为阴性对照。结果表明,嵌合组氨酸系统是高度正交的,可以在原核细胞和真核细胞中实现高效率引入。
4. 构建其他正交对
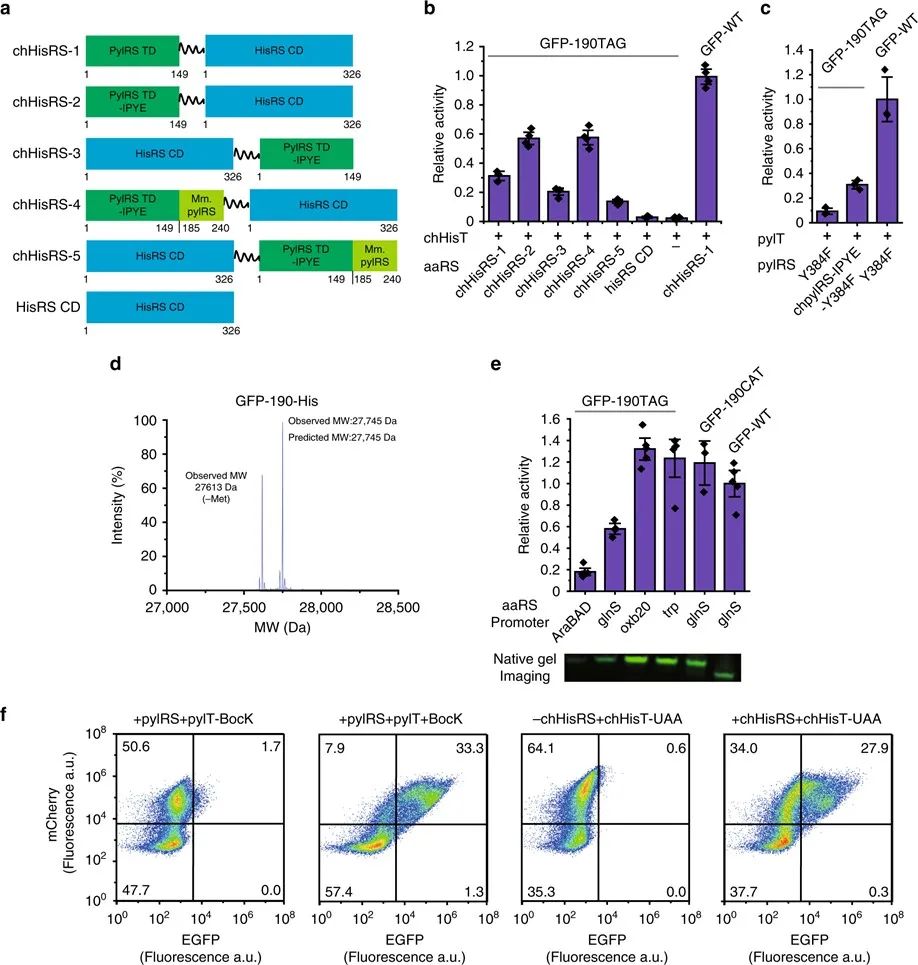
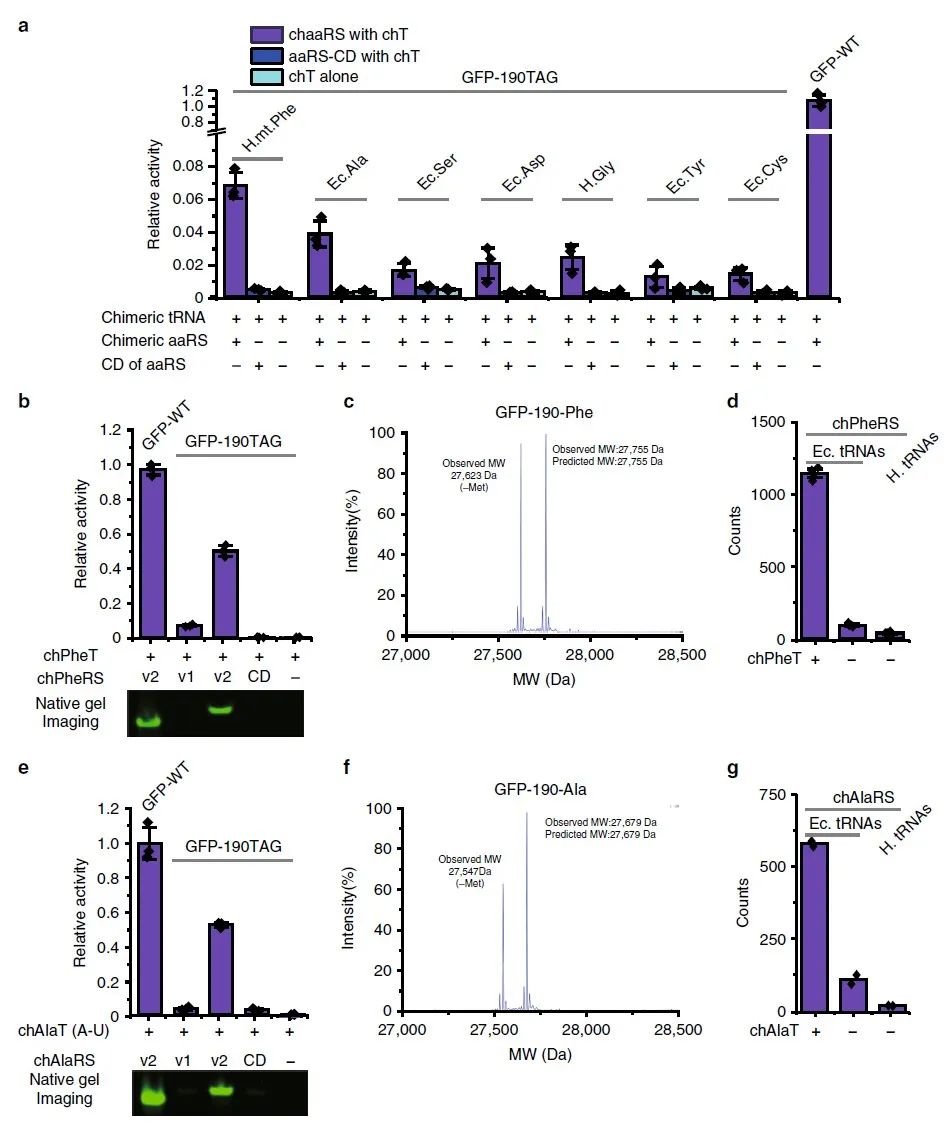
接下来,作者探讨了其他aaRS/tRNA对是否可以与这种合理的嵌合体设计正交,其中的难点就是实现aaRS/tRNA对的正交性。与HisRS不同,大多数经典aaRS中的催化域和tRNA结合域通常是融合的,这与HisRS中这两个域之间的明显分离形成对比。因此,很难预测其催化结构域的截短是否会影响催化活性以及融合蛋白是否允许合适tRNA结合和氨酰化。作者调查了蛋白质数据库中来自大肠杆菌或人类的各种aaRS的结构,从而寻找分离其催化结构域,同时对其氨酰化活性的影响最小的aaRS/tRNA对,最后选了16对用于后续实验。作者通过在催化结构域的N端融合pylRSTD并根据chHisT的经验构建同源tRNA,通过合理设计这些aaRS,成功鉴定了七个有活性的嵌合aaRS/tRNA对。作者还通过LC-MS及LC-MS/MS分析,证实了一些嵌合aaRS/tRNA对的正交性。
5.非天然氨基酸的引入
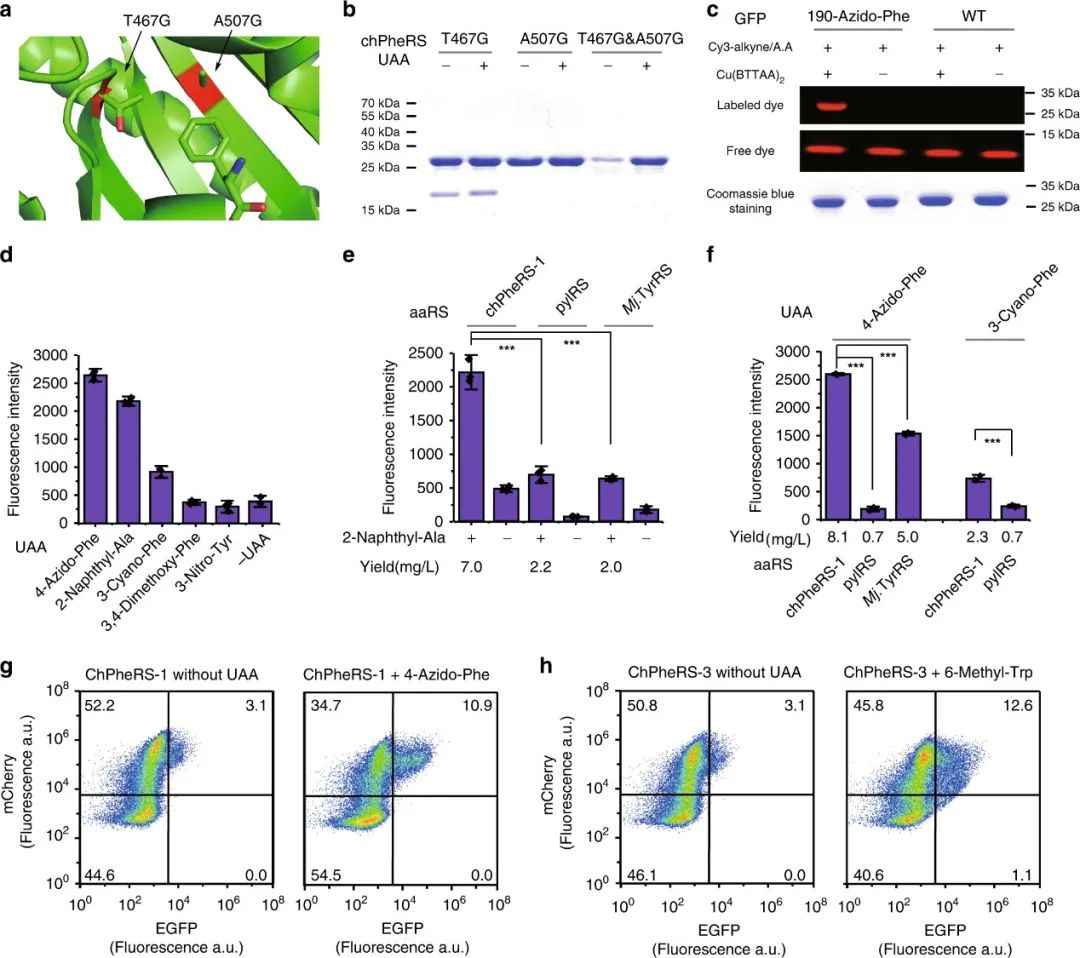
在成功设计了几个正交的aaRS/tRNA对后,作者进一步改造了嵌合体底物特异性,以便引入除了天然氨基酸之外的非天然氨基酸。作者选择了嵌合 PheRS/tRNA 对作为示例,在chPheRS残基中,由于Thr 467和Ala507对Phe的识别至关重要,所以作者将Thr467和Ala507突变为Gly以排除内源性Phe的识别。然后作者通过凝胶内荧光标记含炔的荧光团以及纯化的蛋白质验证了chPheRS-1对4-Azido-Phe的引入,并且发现chPheRS-1对2-Naphthyl-Ala和3-Cyano-Phe等Phe结构类似物显示出多特异性。同时,在和其他正交体系(如PylRS,Mj.TyrRS)对比发现,对4-Azido-Phe,3-Cyano-Phe的引入效果更好。此外,进化的chPheRS的特异性可直接转移到哺乳动物细胞中,无需进一步改造。
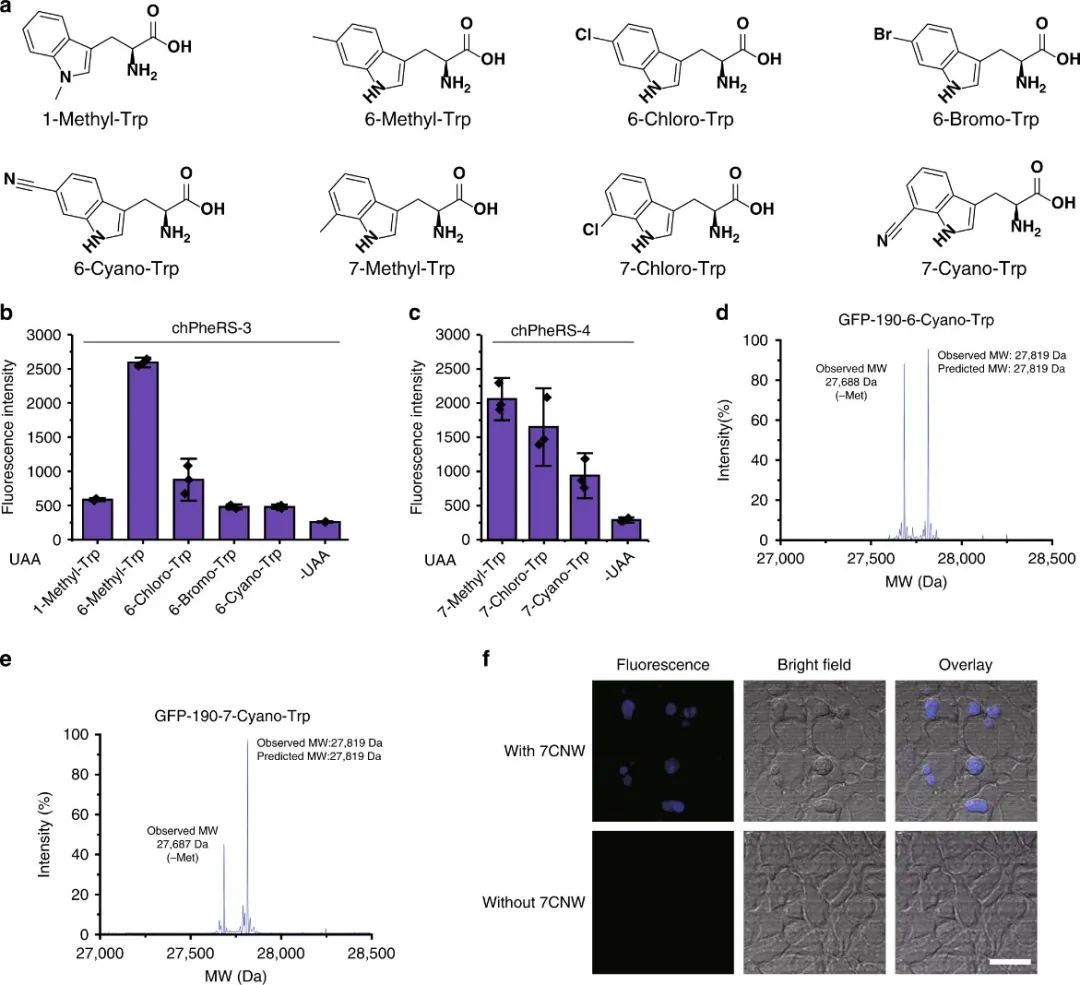
6.色氨酸类似物的引入
作者发现chPheRS-1在没有非天然氨基酸的情况下识别内源性Trp,导致相对较高的背景活性。因而,可以进一步改造chPheRS以在原核生物和真核生物中引入Trp类似物。作者鉴定了两种chPheRS变体(chPheRS-3:E391D、T467G 和 A507G;chPheRS-4:F464V、T467G 和 A507G)对Trp类似物显示出很强的多特异性。chPheRS-3对N1和C6取代的Trp 类似物表现出较高的活性,而chPheRS-4对C7取代的Trp类似物表现出较高的活性,对内源性Trp的背景活性较低。另外作者使用双光子激发显微镜在哺乳动物细胞中观察chPheRS-4可以在哺乳动物中表达。这些数据表明,可以使用这些嵌合体系统在大肠杆菌和哺乳动物细胞中对一系列具有不同取代和化学特性的Trp类似物进行遗传编码。
综上所述,作者充分利用吡咯赖氨酸对的关键正交部分,成功地设计了多个正交的aaRS/tRNA对并且得到了与吡咯赖氨酸对的活性相当的正交对,其在原核生物和真核生物中是完全正交的。作者的研究广泛地扩展了正交aaRS/tRNA对的数量,并为遗传密码扩展提供了更多的正交aaRS口袋。







order prandin 2mg online cheap – purchase empagliflozin pills buy empagliflozin cheap
EfYXGUOVKlQcmqn
HGVSKmPlB
glyburide 5mg drug – micronase 5mg pill dapagliflozin 10 mg cost
stromectol otc – buy generic doxycycline buy cefaclor capsules for sale
cheap albuterol inhalator – buy cheap generic promethazine where can i buy theophylline
order generic zithromax – buy metronidazole 400mg generic order ciplox 500mg online
buy cleocin paypal – suprax 200mg usa chloromycetin online buy
buy generic augmentin over the counter – bactrim 480mg uk order ciprofloxacin 1000mg generic
purchase amoxicillin pill – order amoxicillin sale buy ciprofloxacin 1000mg for sale
anafranil 50mg us – paroxetine uk doxepin where to buy
buy atarax 25mg generic – hydroxyzine 10mg cost cost endep
seroquel medication – cheap eskalith sale buy generic eskalith for sale
clozapine cost – buy frumil 5mg without prescription buy pepcid generic
glucophage drug – buy cefadroxil generic cheap lincocin
zidovudine over the counter – where can i buy biaxsig cheap zyloprim
buy lasix medication – order minipress 1mg sale purchase captopril generic
buy acillin without prescription ampicillin cheap buy amoxil medication
flagyl cost – order flagyl 200mg pills buy azithromycin cheap
ivermectine – brand ciprofloxacin tetracycline cheap
order valtrex 500mg sale – cheap valtrex buy zovirax 400mg generic
order ciprofloxacin 500mg for sale – tinidazole 300mg drug erythromycin pills
flagyl 200mg over the counter – metronidazole 400mg tablet purchase azithromycin
order cipro 1000mg online cheap – order bactrim 960mg pills buy generic augmentin 625mg
buy cipro 1000mg – septra online amoxiclav buy online
buy lipitor 10mg online cheap cheap atorvastatin lipitor over the counter
sjgpXmdWV
fiWDmUGAKVRokSNx