2019年6月,曼彻斯特大学生物技术研究所Anthony P. Green团队在Nuture上发表了题为“Design and evolution of an enzyme with a non-canonical organocatalytic mechanism”的文章,展示了一种具有非标准有机催化机制的酶的设计和进化过程。
设计具有类似于自然界中发现的复杂催化机制的水解酶是一项艰巨的挑战。天然水解酶通常使用含有活化亲核试剂和氢键供体的催化三联体,以稳定氧阴离子中间体。尽管计算方法能够准确设计组氨酸、半胱氨酸和丝氨酸亲核试剂,但非反应性酰基酶中间体的形成损害了催化功能,水解酶的合成模拟物和源自合成肽的自组装α-螺旋桶也受到类似的限制。为创建一个功能性水解酶,作者选择了David Baker团队此前为Morita–Baylis–Hillman(森田-贝里斯-希尔曼)反应计算设计的酶BH32(图1)作为催化重塑的模板。BH32是通过Rosetta软件设计的并引入了12个活性位点突变,将组氨酸亲核试剂(His23)嵌入到来源于超嗜热古菌Pyrococcus horikoshii的卤酸脱卤酶中所得到的酶。
图1 BH32示意图
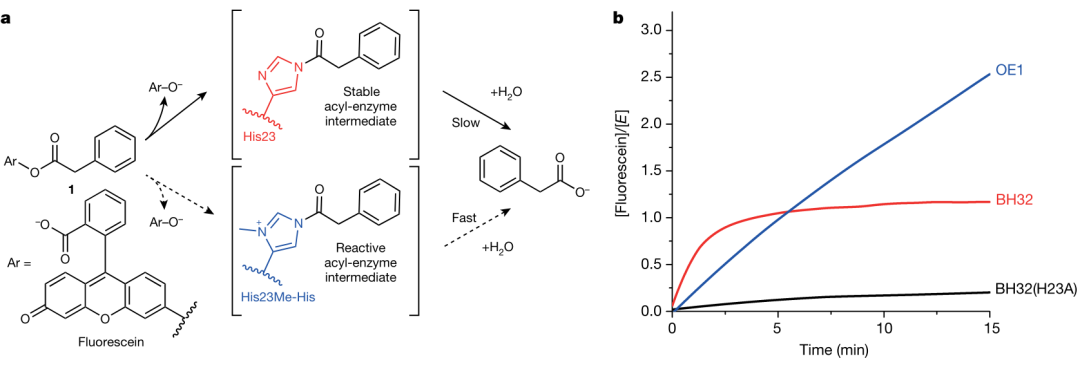
作者首先评估了BH32对一系列单酰化荧光素衍生物的水解活性。如图2所示,催化水解荧光素2-苯乙酸酯,并于500 nm下测定荧光素产物吸收值。与先前设计的酯水解催化剂一致,反应概况(产物随时间的生成)呈现双相行为,反应初期产物的快速积累与酶的快速酰化相关,随后是缓慢的水解转化。His23Ala的突变消除了产物快速积累的阶段,这说明酰化是通过设计的His23亲核试剂进行的。在最初的爆发之后,BH32的底物水解速率与His23Ala变体和背景化学水解速率没有区别。这些结果表明,His23-酰基中间体是稳定且耐水解的,也因此削弱了BH32的催化功能。
图2 含亲核性His23和Me-His23残基的BH32的表征
为了进一步了解反应机理,作者使用抑制剂2-溴苯乙酮将BH32烷基化,得到酰基酶中间体的结构类似物,并通过分析晶体结构发现亲核组氨酸确实通过Nε原子反应(图3)。作者认为BH32 在酯水解过程中积累的酰基咪唑中间体的稳定性可能是由于非配位的Nδ原子在酰化后失去一个质子而呈电中性所致,并假设用非标准的N δ-甲基组氨酸(Me-His)亲核试剂替换His23可以生成一个反应性更强的酰基酶中间体。随后使用工程化的吡咯赖氨酰-tRNA 合成酶与吡咯赖氨酰-tRNA来引入Me-His23残基,这使得水解转化率显著增加,即提供了一种通过非经典有机催化机制起作用的功能性酯酶OE1。这一结果支持了作者的假设:生成反应性更强的酰基酶中间体能够提高水解酶的转化率。
图3 受2-溴苯乙酮抑制BH32的结构表征
作者进一步对OE1进行实验室进化。所使用的进化策略包括局部和全局突变:先使用组合活性位点饱和突变(CASTing)来靶向活性位点残基,包括那些靠近亲核试剂的残基;然后利用易错PCR靶向整个基因,从而识别出“热点”。然后选择21个残基,并通过饱和突变单独随机分组,最终得到OE1.3,其催化效率(kcat/KM)是OE1的15倍,是溶液中游离Me-His的9000倍以上,比常用的有机催化剂二甲氨基吡啶(DMAP)的效率高约2800倍。OE1.3水解荧光素2-苯乙酸酯的反应过程曲线是线性的。用丙氨酸(OE1.3(Me-His23Ala))或组氨酸(OE1.3(Me-His23His))取代Me-His23亲核试剂会有效地消除该酶的水解活性,这表明其催化功能严格依赖于非标准氨基酸的存在。
图4 OE1.3的进化与表征
为深入了解酶活提高的原理,作者分析了OE1和OE1.3的晶体结构(图5)。Me-His的甲基延伸到蛋白质内的一个小口袋中,被残基Ile26、Met27、Leu42、Tyr45和Phe87的侧链所包围。与OE1相比,OE1.3在Me-His咪唑环平面上出现了约15度的小旋转。Ala19His和Ser22Met突变分别位于环平面的上方和下方,降低了Me-His的旋转自由度。Asn46的酰胺侧链与两个水分子形成氢键,使它们靠近Me-His23和His19。这与Tyr45的酚侧链结合,形成了一个极性相互作用网络,其可能在反应中的质子转移和/或水传递中发挥作用。此外,引入的最后一个突变(Leu10Pro),使kcat增加了3倍,该突变扩大了活性位点口袋,诱导了蛋白的主链重排,从Phe7延伸到Leu13。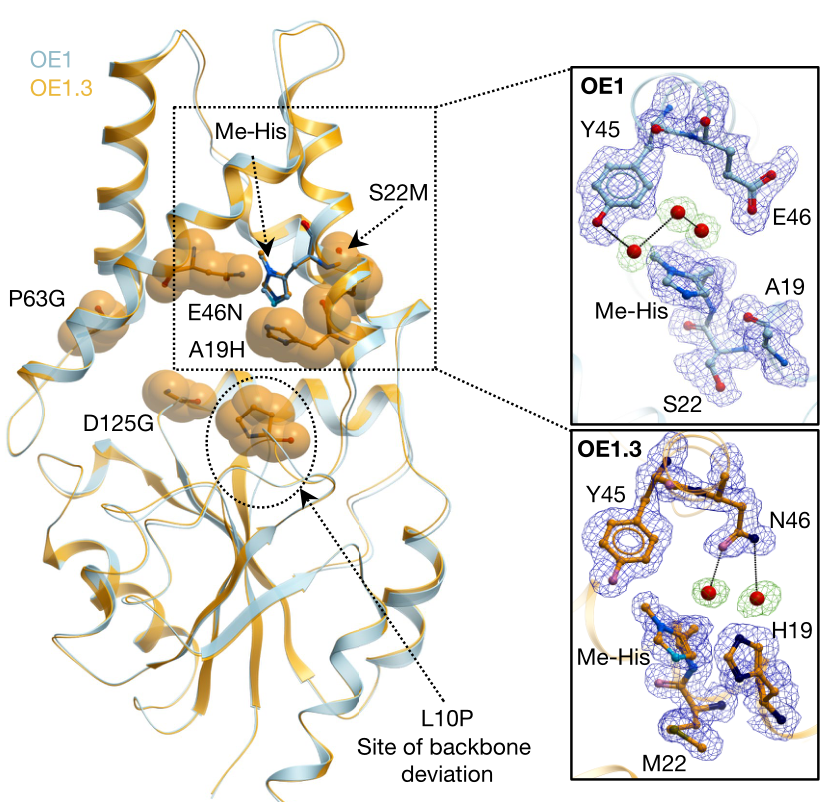
图5 OE1与OE1.3的晶体结构
作者接下来评估了OE1和OE1.3对一系列荧光素酯的活性(编号2-6)。具有供电子(2)和吸电子(3)苯基取代基、杂环(4和6)和空间要求高的萘基(5)的底物都具有良好的耐受性。然而,与非手性底物相比,α-甲基取代基(R)-7和(S)-7的引入导致酶活性显著降低。为了证明设计的水解酶能够促进对映选择性转化,作者对OE1.3进行了进一步的研究。对荧光素(R)-2-苯丙酸酯((R)-7)的活性进行筛选,筛选出OE1.4,该变体优先水解(R)-7,比其对(S)-对映体的活性高8倍,与母模板OE1.3相比,提高了15倍。突变聚集在前一轮进化中的Pro10周围。这表明,该人工酶可以通过安装相对较少数量的突变,很容易地适应执行新功能。
图6 OE1.3的底物多样性和OE1.4的对映体选择性
综上所述,作者利用扩展的遗传密码获得了一种通过非标准有机催化机制运作的酶。通过细胞翻译机制直接引入反应性亲核试剂使人们能够通过实验室进化优化酶的性能。该研究将促进蛋白质内非标准氨基酸引入技术的发展,以编码具有不同反应模式的功能氨基酸新家族。将这种“受化学启发的”催化功能集成到计算设计算法中,将提供一个强大且通用的策略,以生成具有自然界无法获得的功能的酶。
论文链接:https://doi.org/10.1038/s41586-019-1262-8










order glycomet sale – buy glucophage without a prescription order generic acarbose 50mg
glyburide 2.5mg cost – glipizide 10mg sale order forxiga generic
desloratadine order – buy cheap triamcinolone buy albuterol inhalator sale
Wow, superb weblog format! How long have you ever been blogging for?
you made blogging glance easy. The entire look of
your website is wonderful, as smartly as the content material!
You can see similar here sklep
buy depo-medrol paypal – buy zyrtec 5mg generic buy astelin without a prescription
ventolin cost – advair diskus oral order theo-24 Cr 400mg without prescription
stromectol uk buy – buy generic aczone for sale cefaclor 500mg canada
order cleocin 300mg pills – order cefpodoxime 200mg for sale order chloromycetin sale
Good post. I learn something new and challenging on websites I stumbleupon everyday.
It’s always useful to read content from other authors
and practice something from other websites.
Also visit my homepage :: vpn special coupon code 2024
I was able to find good information from your blog posts.
my page: vpn coupon 2024
buy amoxicillin cheap – purchase trimox without prescription buy cipro generic
amoxiclav sale – order amoxiclav ciprofloxacin sale
hydroxyzine for sale online – order fluoxetine 20mg online cheap purchase endep generic
anafranil 25mg cost – imipramine for sale order generic doxepin
purchase seroquel pills – bupron SR where to buy eskalith over the counter
buy clozaril cheap – glimepiride generic buy pepcid online
buy retrovir generic – allopurinol 300mg generic
buy generic metformin 1000mg – lincomycin pills order lincocin 500 mg pills
furosemide 40mg pill – order prazosin without prescription capoten 25 mg generic
metronidazole medication – flagyl without prescription purchase azithromycin pill
ampicillin pills purchase penicillin where can i buy amoxicillin
NbKwhJaRt
buy valacyclovir 1000mg for sale – buy starlix 120mg without prescription order acyclovir 400mg online
ivermectin pills canada – purchase sumycin pill buy sumycin pill
metronidazole pill – buy amoxil pill cheap azithromycin 250mg
oral ciplox 500mg – order tinidazole 300mg pills erythromycin 500mg generic
order cipro without prescription – buy augmentin 375mg online cheap clavulanate uk
order ciprofloxacin 1000mg generic – buy cipro 1000mg generic purchase augmentin pills
buy lipitor pill atorvastatin 40mg ca buy atorvastatin medication