当年还是新手的时候,曾经在网上读过不少关于提取RNA心得体会的文章。如今从事科研已经十年有余,现在回过头再去读那些文字,就会发现其中不少“经验”仅是“玄学”。这篇文章将破除一些迷信。
一、什么方案都比不过说明书
对于提取RNA的新手来说,无论是打算用试剂盒还是用Trizol法,首先需要阅读的是说明书,而不是网上的经验文(对,包括我这一篇)和实验方案。良心的试剂厂商在销售产品之前,会对其使用方案进行反复测试。因此,说明书中所提供的实验步骤,才是最准确的。
二、经典Trizol法并不能获得总RNA
这个事实可能会刷不少新手甚至老手的三观,但确有实验支持:经典Trizol法会选择性丢失低GC比的miRNA。这一点,源自一则作者自撤稿的故事。
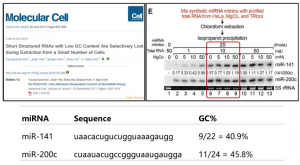
V. Narry Kim是韩国鼎鼎大名的美女科学家,专做RNA相关的研究,包括miRNA。几年前她们组发现一个奇怪的“现象”,即贴壁细胞在消化之后,会有一些miRNA的丰度突然降低,看起来好像是被快速“降解”掉了,并据此写了一篇文章发到Molecular Cell上。但很快她们就发现,这个“现象”难以重复:如果用Trizol做实验,就一定是阳性结果,而用试剂盒提RNA,就重复不出来。难道是号称能提总RNA的Trizol方案出了问题?确实如此。
经进一步实验后发现,经典的Trizol方案会使得低GC比的miRNA丢失。如下图实验中,她们在不同总量或者说浓度的总RNA中,混入20 fmole的miR-141和miR-200c。然而,在总RNA量少的情况下,GC%比较低的miR-141,提取出来的相对浓度就会低于miR-200c。但这也不是说,Trizol法就完全不能用了。她们组还发现,在Trizol中加入10 mM的MgCl2,可以解决选择性丢失低GC比小RNA的问题。最后,V. Narry Kim写信给杂志社编辑部,要求撤除之前的文章。
试剂盒法,同样也是得看柱子是否支持抽提小RNA。目前市面上有仅富集小RNA、丢弃小RNA仅纯化大RNA,以及提取总RNA三种。总之又回到第一点,先看说明书,读完再动手。
三、对实验环境的要求并没有想象中那么苛刻
我在小本的时候曾去过某实验室实习,发现他们有专门的一个小隔离空间来提RNA,进去还得戴口罩。网上也有许多文章说,RNase很恐怖,所以到处都要擦得bling bling才能做实验。甚至还有许多试剂厂商推出了专门用来擦桌子的喷雾……对,RNase可怕这一点并不假,但也没有网上说得那么夸张,好像空气中弥漫的RNase都能榨出汁来的样子。
我本人提了那么多年RNA,从来就不用那些很夸张的措施。穿好实验服戴好手套,保护好自己就好。口罩爱戴不戴,反正我从来不戴。做实验时高冷一点,不要指点江山、口沫横飞即可。对了,勤换手套,甚至离一次心换一次的,也是玄学。
四、醇沉淀不是越多就越好
有些实验方案会推荐,在异丙醇沉淀后,用乙醇沉淀两次。实际上,任何提取实验,都会在纯度和得率这一对矛盾中取舍。醇沉淀会将脂溶性杂质去掉,但部分非脂溶性的杂质依然会连同RNA一起被沉淀下来。因此,多整几次,并不会让RNA的纯度翻倍,反而还会有降低得率的风险。一般情况下,异丙醇和乙醇各沉淀一次即可。但是,倘若预计RNA浓度很低,那就只能放弃纯度,在低温沉淀数小时,以换来较高的得率。
五、围绕DEPC的玄学
许多实验方案会推荐使用0.1% DEPC处理RNA相关用水,以灭活RNase。这一点是要肯定的。不过,在使用DEPC的过程中,又充斥着一些玄学。
首先,高压灭菌后的DEPC水,会有一股“香甜”的味道。许多人会以为那是残留的DEPC而不敢用。实际上,这只是DEPC分解成CO2和乙醇后,产生的一些挥发性酯类副产物。
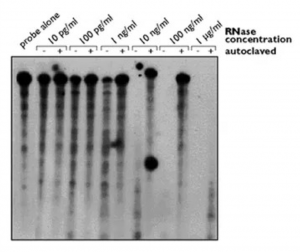
其次,单纯高压过的蒸馏水或超纯水,基本可以视为无核酸酶活性等级的水。Thermo Fisher公司曾经做一项实验来说明这个问题。
如下图所示,在PBS中加入不同浓度RNase A,高压或不高压,后溶解P-32标记RNA 探针。最后数据显示,除非原始的RNase A的浓度高达1 µg/ml,否则常规高压过的水,基本检测不出RNase A活性。当然,Thermo的科学家也很谨慎,说这个结论仅适用于RNase A,不能推广到其他的RNase类型。
目前,我本人不使用DEPC来处理RNA实验相关试剂和耗材,因为太费劲,而且DEPC还有毒性。相关的液体试剂,我会使用从公司购买的Nuclease-free的水来配制。没有很贵,一小瓶够用很久。很多时候买各种其他试剂,比如酶、siRNA等,也都会送这样的水。在耗材方面,直接使用大公司的离心管和吸头,根本不用担心核酸酶的问题。
最后要注意的是,DEPC并不是万能的,尤其是无法处理含有Tris、HEPES等含胺类的溶液,除非加到很高的浓度。









micronase 2.5mg price – glyburide sale buy forxiga 10mg generic
desloratadine 5mg price – purchase ketotifen generic albuterol over the counter
Wow, fantastic weblog layout! How lengthy have you ever been blogging for?
you made blogging look easy. The overall look of your web site is wonderful, as smartly as
the content material! You can see similar here sklep online
depo-medrol online – montelukast order azelastine price
buy ivermectin 3 mg for humans – can you buy stromectol over the counter cefaclor capsules
cleocin pills – order terramycin 250 mg online cheap chloramphenicol tablets
azithromycin 250mg over the counter – order azithromycin 250mg online cheap ciplox 500 mg drug
buy amoxil paypal – order cephalexin 125mg generic cipro for sale online
oral augmentin 1000mg – order ciprofloxacin 500mg pill cost cipro
buy seroquel 100mg without prescription – purchase seroquel online buy eskalith generic
buy clomipramine sale – mirtazapine 30mg ca buy sinequan 25mg
buy zidovudine 300 mg generic – buy allopurinol pills
purchase clozaril – order clozapine pills pepcid uk
glycomet 500mg for sale – order generic lamivudine buy lincomycin medication
buy lasix medication – purchase coumadin online cheap buy generic captopril
metronidazole 400mg tablet – buy azithromycin 500mg zithromax over the counter
acillin over the counter purchase doxycycline online amoxil over the counter
buy valtrex generic – buy nemazole online cheap buy acyclovir 400mg generic
ivermectin 3mg pills for humans – co-amoxiclav over the counter sumycin 500mg price
generic ivermectin – buy cefixime 200mg generic order sumycin 250mg generic
purchase flagyl – order oxytetracycline 250mg order azithromycin
order ciplox for sale – tindamax online order order erythromycin 500mg for sale
cheap ciprofloxacin – cost cephalexin 125mg augmentin 1000mg drug
ciprofloxacin 1000mg tablet – buy generic keflex over the counter clavulanate sale
atorvastatin 40mg without prescription atorvastatin 40mg usa atorvastatin 10mg cost