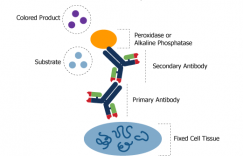
关于蛋白质免疫印迹(Western Blot,即 WB),想必做蛋白实验的小伙伴们都不会陌生,作为免疫学中最常用的一种实验方法,其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色。通过分析条带大小和着色深度获得特定蛋白质在所分析的细胞或组织中表达情况的信息。
但是或许原理大家都懂,实验做起来却并不容易,每次当我们准备好样本,满心以为自己可以做出这样的实验结果时?:
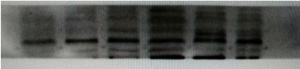
往往得到的图是这样的
这样的
甚至是这样
嗯???这都是什么鬼?
那么为了避免出现以上问题,下面就由小编给大家梳理一下 WB 中常见的问题以及解决方法。
一、信号强度低
信号强度低是指在正常曝光条件下得到的目的条带微弱或是没有目的条带,而增加曝光时间又会导致背景高、杂带多等问题。排除试剂质量、操作失误等方面的影响,这一类问题产生的主要原因如下:
① 样本蛋白表达量不足。建议添加蛋白表达量较高的细胞系作为阳性对照,或是适当增加上样量以获得较高水平的信号;
② 蛋白质降解。在蛋白样品制备期间注意蛋白酶抑制剂 PMSF 的使用,所制备的样品尽快检测或妥善保存;
③ 蛋白的转膜。使用适当孔径的膜,同时优化转膜时间,对于高分子量蛋白可能需要更长的转膜时间。
④ 抗体的使用。抗体的反应种属与实验类型需要能够满足实验的需求,此外,抗体的稀释比、孵育时间等问题也需要在试验中不断优化;
⑤ 蛋白与抗体结合率低。减少洗膜次数或缩短洗膜时间,降低洗膜液中 NaCl 浓度等;
⑥ 抗原被封闭液遮蔽。换用不同的封闭液,优化封闭液中蛋白质浓度并缩短封闭时间;
⑦ 甲醇浓度过高。会导致蛋白质与 SDS 分离,并沉淀在凝胶中,同时使凝胶收缩或变硬,从而抑制高分子量蛋白的转移。实验中可适当降低甲醇浓度或者使用乙醇、异丙醇代替。
二、非特异性条带或条带位置不对
WB 结果中目的条带之外的条带被称为非特异性条带,有时非特异性条带很明显,却没有目的条带,这些情况对结果分析会产生很大的干扰。一般来说引起这类问题的主要因素有:
① 抗体的非特异性结合。通常认为,多抗的特异性不如单抗,更容易产生非特异性条带,而适当降低抗体的浓度有助于减少杂带。同时为了排除二抗非特异性结合的可能,建议设二抗阴性对照;
② 样品蛋白量过高。适当降低上样量,同时延长洗涤时间与封闭时间可避免蛋白量过高对实验结果的不良影响;
③ 蛋白质降解。会导致条带位置变化并产生更多杂带,建议采用新鲜制备的或是冻融次数较少的样品;
④ 细胞传代次数过多。会导致蛋白表达模式的分化,建议使用原始或传代少的细胞株;
⑤ 蛋白存在复合物。有的目的蛋白会和其他蛋白结合形成复合物,导致条带位置改变,需要查阅相关文献来确定蛋白是否会形成稳定复合物;
⑥ 蛋白存在剪接体或多种修饰形式。部分蛋白存在剪切位点,有的剪切体具有免疫活性,在 WB 中也会被检测出。此外有的目的蛋白会存在糖基化位点或其他修饰位点,条带大小可能会远超理论分子量。因此需要查阅文献或是 uniprot 来得知蛋白的剪切体大小以及修饰位点等。
三、背景过高
在部分 WB 结果中,条带之外本应是空白的背景也会有较深的颜色,对分析结果会产生干扰,而且结果图不美观,难以用于文章发表。这种问题的可能原因有以下几点:
① 封闭不充分。背景过高的主要原因之一是封闭有问题,建议使用合适的封闭剂(脱脂奶粉、BSA 等),优化反应浓度与封闭时间,同时注意避免出现抗体与封闭剂的交叉反应,以及封闭剂与含有目标抗原,内源性生物素或者与抗生物素蛋白/链霉亲和素不相溶等问题;
② 洗膜不充分。适当增加洗膜次数和缓冲液体积,提高吐温20的百分比可改善由洗膜不充分导致的背景高的问题;
③ 抗体的使用。一抗浓度过高是高背景的原因之一,且二抗也存在与封闭剂非特异性结合的可能,因此建议适当优化一抗浓度,并设二抗阴性对照;
④ 曝光时间长。建议在实验中采用合适的曝光时间。
四、条带弥散或形状怪异
有时 WB 结果图中条带位置符合预期,但却因为条带弥散、形状怪异等因素导致无法使用,出现这种情况多半是制胶或电泳过程出了问题,具体如下:
① 电泳时电压、电流过高。会导致条带迁移速率过快以及 SDS-PAGE 温度升高,并可能使得条带弥散、形状变形。建议使用合适的电泳条件并保持低温;
② 电极不平衡。会导致条带偏斜,上样时在无样品的胶孔中加入等量样品缓冲液可避免这种情况;
③ 上样量过高,样品中盐离子浓度较大。上样量过高可能会导致条带弥散,样品中的盐离子浓度不一致则会导致条带不齐等问题。因此在上样时需保证样品量一致且适当,并保持相同的、较低的盐离子浓度。
④ 制胶问题。在配胶时一定要保证充分混匀,均匀凝胶,上样前用针头将胶孔拨正并吹出胶孔中的气泡。
⑤ 电泳缓冲液存放过久。电泳实验中的缓冲液如果放置过久也会对结果有不良影响,因此建议及时更换新的缓冲液。
五、膜上散布不均匀的污点
有时在 WB 做出结果后,除了目的条带以外,膜上还分布着不规律的污点,对结果也会有较大的干扰。这类问题产生的主要原因有以下几点:
① 试剂、仪器等污染。建议在每次实验前后注意清理实验仪器,同时及时更换出现问题的试剂;
② 转膜时有气泡。确保在转膜过程中将气泡排除干净;
③ 抗体孵育时与膜接触不充分。确保在抗体孵育过程中,液体总量足够,同时将抗体均匀配置,并在摇晃的条件下进行孵育;
④ 曝光时间。过度曝光会导致斑点更明显,建议采用合适的曝光时间;
⑤ 膜干燥。实验中要保证有充分的反应液,避免出现干膜现象。
以上就是本次分享的全部内容,看完这一大堆之后是不是觉得头都大了?那么有没有什么方法能够简单、省心还能得到好的实验结果呢?
当然有!为了帮助大家做出更美观 WB 图,诺禾致源最新推出了的 simple Western 服务,像这样的 WB 结果图想不想要?
简洁、美观同时便于数据分析,目前已获得包括《Nature》、《Science》、《Cell》在内的多个顶级期刊的认可。
了解更多,发送邮件至 novoab@novogene.com 进行咨询。
抗体研究部 周广庆丨文案
孙津津丨编辑
图片来源于网络,侵删










Этот информационный обзор станет отличным путеводителем по актуальным темам, объединяющим важные факты и мнения экспертов. Мы исследуем ключевые идеи и представляем их в доступной форме для более глубокого понимания. Читайте, чтобы оставаться в курсе событий!
Узнать больше – https://vyvod-iz-zapoya-1.ru/
Wybierając Casino Slottica Polska, zyskujesz dostęp do ekskluzywnych promocji, w tym bonusu powitalnego 250 do 1600 zł oraz 300 darmowych spinów na najpopularniejsze gry. Niezależnie od tego, czy grasz na komputerze, tablecie czy smartfonie, nasza platforma zapewnia płynne działanie na każdym urządzeniu. Sprawdź już dziś i dołącz do społeczności ponad 500 000 aktywnych graczy z całego świata!
http://www.agisko.pl/
Why people still use to read news papers when in this technological globe everything is existing on net?
Very interesting topic, thank you for putting up.
Well I definitely enjoyed reading it. This subject offered by you is very constructive for correct planning.
Valuable material. With thanks!
ni online casino https://casinocashstars.com/review-betonline/ casino online spel
I like what you guys are up too. Such clever work and reporting! Carry on the excellent works guys I’ve incorporated you guys to my blogroll. I think it’ll improve the value of my site :).
[url=https://www.dnb.com/business-directory/company-profiles.sked_technologies_ltd.f03d60f876bca96fe17335af75ea170f.html]dnb.com[/url]
xumyoc
You said that perfectly.
online casino sofortГјberweisung geld zurГјckfordern top online casino casino nj online
This is nicely said! !
online casino photos jackpot city casino canada online casino no id needed
Nicely put, Thanks!
jazz casino online casino onlines best online casino first deposit bonus
You actually expressed it superbly.
top online casinos jamaica real money online casino no deposit bonus codes live social casino online
xg7x0v
You reported it terrifically.
online casino gruppe new online casinos for usa online casino like zula
This is nicely put. !
free online casino slot games for ipad casino online real money usa william hill online casino usa
Nicely put. Thank you.
poker casino online party casino canada kassu online casino
You said this adequately.
hawk online casino online casino slots for real money new online casino with free signup bonus real money usa
Nicely put. Regards.
reddit best online casino slots real money online casino canada konami casino games online
Whoa loads of beneficial data!
online casino table games for real money best online casino reddit no deposit bonus bet365 online casino review nj
Amazing posts. Regards.
online live casino usa slot machine online casino online casinos with $10 minimum deposit
Really tons of amazing tips!
bmy88 online casino login online casino slots betus casino rich palms casino online
Position well used..
online casino mit bonus crab online usa casino ssbet77 online casino
You actually stated that fantastically.
agen casino bola88 online casino online games free new free online casino slot games
“Once you plant that cock of yours in some squirmy hole and empty those warm balls of yours into a moist wet hole. Then you are on your way to becoming a man, and only then will you, come-of-age. But it is only a step onto the winding pathway towards manhood. It is my job to teach you what it means to be a man.” His father stands as he finishes his sentence. Loosening his belt and pulling his shirt out from the tucked confines of his pants.
Awesome facts. Regards!
luva bet casino online best online casino no deposit sign up bonus casino online czech republic
Useful knowledge. Cheers!
gta online diamond casino heist security intel real cash online casino 1red online casino
Kudos, Loads of forum posts!
casino online regalo sin deposito online casino sites apuesta casino online
Seriously plenty of wonderful facts!
christchurch casino online login no deposit online casino real money online casino australia paypal
Amazing information. Thanks a lot.
usa online casino no deposit bonus codes online casino games real money online casino with fastest payout
Factor effectively considered..
free online poker casino world real money online casino no deposit bonus codes caribbean treasures online casino
Many thanks, An abundance of posts!
online games casino free play casino slots for free online 2018 best online casinos us
Kudos. Quite a lot of postings.
online casino new zealand real money top 10 online casino new jersey new online casino
“Was it because of that?” His dad asks as he points a finger towards him. And his midsection. “My hard-on. Somewhat. But I have them all the time. You know that. You’ve made enough comments about me sportin’ boners in the morning when you see them at breakfast.”
Cheers, Plenty of forum posts!
best online casino cash out [url=https://usagamblinghub.com/#]online casino bonus no[/url] online casino uk fast withdrawal
Very good data. Many thanks!
tropicana online casino.com [url=https://usacasinomaster.com/#]online casino bonuses[/url] online casino mauritius
Wow many of wonderful material!
hi lo online casino [url=https://luckyusaplay.com/#]casino game online[/url] win win online casino
Useful stuff. Thanks!
mejores casinos online en argentina [url=https://luckyusaplay.com/#]best casinos online[/url] spela online casino utomlands
“It was intense. Really intense. We ran so many drills. I am exhausted.” He explains. sex porn mom “What did Coach have to say when he saw all those hard-young cocks in the locker room?” His dad asks.
Seriously quite a lot of awesome knowledge.
firekeepers online casino login free play casino online usa are there any american online casinos
Terrific forum posts, Kudos!
best zimpler online casino no deposit online casino usa valley forge casino online slots
Reliable knowledge. Kudos!
popular casino online new online casinos usa phl63 online casino register
Fantastic write ups. Thank you!
acorn online casino real money [url=https://uscasinoguides.com/#]new online usa casinos[/url] free casino games not online
Cheers, Terrific stuff!
online casino in the philippines [url=https://usaplayerscasino.com/#]biggest online casino[/url] betrivers online casino login
You’ve made your stand pretty well!!
online casino no deposit bonus bulgaria online casino free play no deposit what are online casino bonuses
Nicely put, Appreciate it!
online casino support jobs [url=https://usagamblinghub.com/#]online games casino[/url] aprire un casino’ online franchising
Reliable facts. Thank you!
online casino 10 euro ohne einzahlung online casino bonus codes casino royale online netflix
Thanks. Excellent information.
pala online casino nj online casino bonus no online casinos to play
Cheers, Numerous knowledge!
american casino tv show watch online [url=https://luckyusaplay.com/#]new online casino[/url] hard rock casino online login
Nicely put, Appreciate it.
casino online efbet best online casinos usa new 2021 usa online casinos
Superb write ups. Thank you.
bombay casino online [url=https://uscasinoguides.com/#]casino gambling online[/url] nine online casino
Nicely put, Many thanks!
247 casino online [url=https://usaplayerscasino.com/#]casino online no deposit bonus[/url] 21 online casino game
This is nicely put. !
gta online casino price [url=https://usagamblinghub.com/#]online casino deposit bonus[/url] casino online bonus ohne einzahlung
Useful info. Cheers.
casino online esc best casinos online betway online casino app
Thanks a lot, I appreciate it!
online sports casinos [url=https://usacasinomaster.com/#]usa online casino[/url] online internet casino
Thanks a lot! A lot of write ups!
online casino book online betting casino best secure online casino
Terrific posts. Many thanks!
australian online casino free spins [url=https://luckyusaplay.com/#]top rated online casinos[/url] gta 5 online casino scope out locations
Nicely put, Thanks a lot!
zeus casino online online live casino best online casino real money free play
Kudos! Loads of data.
nuevos casino online online casino game top online casinos panama
Amazing a lot of wonderful material!
online keno casino [url=https://uscasinoguides.com/#]us online casinos with rtg software[/url] il online casino
You actually explained that wonderfully.
legal arizona online casinos no deposit online casinos no deposit bonus online casino nj
Many thanks! Lots of material!
online casino free bonus without deposit [url=https://usagamblinghub.com/#]online casino free play[/url] australian online mobile casino no deposit bonus 2017
Information nicely utilized.!
new online rtg casinos casino gambling online online casino spiele kostenlos
You revealed this effectively!
casino gamble online [url=https://usacasinomaster.com/#]us casinos online[/url] slot vegas casino online
Nicely put. Thanks a lot!
boom casino online usa online casino no deposit online casino stake
Useful stuff. Cheers.
free online casino nz [url=https://luckyusaplay.com/#]best online casino reddit no deposit bonus[/url] online casino blockchain
Useful postings. Thanks!
gta online all casino scope points new online casinos usa real money list of online casinos nz
You actually expressed that fantastically.
ruleta casino online online casino no deposit bonus codes cosmo casino online
Truly a good deal of helpful facts!
udenlandske online casinoer [url=https://uscasinoguides.com/#]live online casino[/url] casino online grand ivy
Awesome material. Regards.
online casino no documents required online casino welcome bonus online casino 20 minimum deposit
You have made your point extremely effectively!.
sugarhouse casino online sports betting [url=https://usaplayerscasino.com/#]online casino welcome bonus[/url] riversweeps online casino no deposit bonus
Really many of superb data.
all uk online casinos deposit bonus online casinos online casinos ohne beschränkung
You stated this superbly!
12win casino online download [url=https://usacasinomaster.com/#]new online casino no deposit bonus usa[/url] litecoin casino online
Whoa many of valuable data!
deposit casino online online casinos for united states online casino app
You mentioned it fantastically.
what are the best online casinos for real money [url=https://luckyusaplay.com/#]live casino online[/url] pragmatic play online casinos
Regards! Terrific stuff!
online casino that takes visa best online casino bonus mejores casinos online mexico
Fantastic stuff, Thanks!
free cash online casino online gambling casino best online casino easy withdrawal
With thanks! A lot of posts.
casino online udenlandsk [url=https://usaplayerscasino.com/#]top rated online casinos[/url] holland casino online
Nicely put, Cheers!
australian online casino online casino top snoqualmie casino online promo code
You suggested it adequately!
online casino spel [url=https://usagamblinghub.com/#]no deposit casino bonus usa online casinos[/url] betano casino online
You said it perfectly..
online holland casino free casino online situs casino online terbesar
You suggested it fantastically.
australia casino online paypal [url=https://usacasinomaster.com/#]online casino sites[/url] olympia casino online
With thanks. An abundance of information!
brabet casino online [url=https://luckyusaplay.com/#]social casino online[/url] gta online casino heist avi schwartzman
Kudos! Good information!
bbin online casino singapore top 10 online casino iowa online casinos
Thanks, Fantastic stuff!
online casino agent hiring work from home no experience no deposit bonus online casino mgm detroit online casino
You actually revealed it terrifically.
juicy vegas online casino [url=https://uscasinoguides.com/#]us casinos online[/url] online united states casino
You actually reported it wonderfully.
online casino without id us casinos online gta online casino heist loading forever
Awesome knowledge. Many thanks.
online casino ДЌeskГ©m [url=https://usacasinomaster.com/#]gambling casino online[/url] free online vegas casino
Thanks a lot! Valuable stuff.
online wv casino deposit bonus casino online vegas frontier online casino
Truly plenty of excellent advice!
new online casino nz no deposit [url=https://luckyusaplay.com/#]new online casino[/url] online casinos in nevada
Amazing lots of good knowledge!
casino online que acepta halcash espaГ±a best online casino no deposit bonus online casino real money free spins usa
Helpful tips. Many thanks.
online casino 10 euro startguthaben [url=https://uscasinoguides.com/#]online casino bonus no[/url] play free casino games online no download
Nicely put, Cheers.
canadian online casinos free play [url=https://usaplayerscasino.com/#]monkeytilt best online casino[/url] alantic city gden nugget casino online
You have made your point quite clearly..
gta online casino heist how to get diamonds united states online casino free money registering online casino
Incredible a lot of superb data.
best bf games online casino [url=https://usagamblinghub.com/#]biggest online casino[/url] big jackpot online casino
Awesome postings. Thank you.
los mejores casinos online de argentina new online usa casinos best online casinos that accept paynearme
Superb postings. Cheers!
deposit $5 online casino [url=https://usacasinomaster.com/#]casinos gambling online[/url] online casino games apk
Terrific data, Thanks.
bet us online casino best online usa casinos gta 5 online casino heist scope all access points
Superb write ups, With thanks.
online casino real money free spin singapore [url=https://luckyusaplay.com/#]online casino bonus[/url] holland casino online roulette
Cheers! Quite a lot of data!
dublin online casino online casino free bonus no deposit casino online bez depozytu bonus
Excellent data. Regards.
casino online inte svenska [url=https://uscasinoguides.com/#]gambling casino online[/url] online casinos with freeplay
Helpful forum posts. Thanks!
lucky chances casino online [url=https://usaplayerscasino.com/#]best online casinos usa[/url] wonder woman casino game online
Many thanks, Lots of information.
online casinos new hampshire online casino free spins no deposit canada top online casinos
Thanks, An abundance of info!
alabama online casino site casino online gambling online casino games real money no deposit bonus
Thanks a lot. I enjoy it!
casumo online casino erfahrungen [url=https://usacasinomaster.com/#]casino online[/url] dragonara casino online
You definitely made your point!
12emerald online casino https://luckyusaplay.com/reddog-review/ online casino sms payment Г¶sterreich
You actually reported that fantastically!
game vault online casino download for android https://luckyusaplay.com/sportsbook/ casino royale in hindi watch online
Thanks a lot. Plenty of postings.
ags online casino https://luckyusaplay.com/mybookie-review/ agen casino sbc168 online
You actually stated this fantastically.
online casino diamond https://usaplayerscasino.com/pennsylvania-casinos/ bestes visa online casino
Cheers! A good amount of information.
casino international online https://usaplayerscasino.com/busr-review/ rtg online casino no deposit bonus
You made your position very well..
online casino blog https://uscasinoguides.com/maryland-casinos/ top 50 online casinos uk
Nicely put, Regards!
nuevo casino online https://usaplayerscasino.com/colorado-casinos/ real money online casino south africa
Great material. Cheers.
jobs online casino https://luckyusaplay.com/safe-casinos/ best online casino with free play
Nicely put. With thanks.
parx online casino no deposit bonus codes https://uscasinoguides.com/crypto-casinos/ mk casino online
Truly plenty of good knowledge.
online casino simulator https://luckyusaplay.com/bitcoin-casinos/ online casinos free
Point well used..
golden nugget online casino games https://usacasinomaster.com/ethereum-casinos/ twin river online casino promo codes
Seriously many of beneficial facts.
casinos online con bonos https://usacasinomaster.com/ignition-review/ free spins casinos online
Truly all kinds of valuable advice!
vblink online casino https://usaplayerscasino.com/real-money-slots/ au casinos online
Good stuff. Thank you.
online casino free bonus no deposit slovakia https://uscasinoguides.com/gambling-apps/ top online casino bonuses
Terrific forum posts. Kudos.
bk8 online casino https://luckyusaplay.com/minnesota-casinos/ 007 casino royal online
Wow all kinds of useful tips!
online casino texas real money https://usaplayerscasino.com/horse-betting/ como hackear casinos online
Excellent stuff. Cheers!
casinos online nuevos espaГ±a https://usacasinomaster.com/betonline-review/ online casino sign up
Helpful information. Thanks.
online casino astropay https://usagamblinghub.com belgian online casino
With thanks, Helpful information!
najbolja online casino https://luckyusaplay.com/colorado-casinos/ 10 dollar deposit online real money casino
Cheers, Loads of advice.
https://usagamblinghub.com/florida-casinos/
Whoa tons of amazing data!
https://uscasinoguides.com/mybookie-review/
purchase calcort pill – cheap calcort pills alphagan us
buy imusporin for sale – order imusporin without prescription buy gloperba pills
oxcarbazepine without prescription – buy synthroid 75mcg online order levothyroxine generic
buy hytrin generic – flomax 0.4mg generic priligy canada
finax online buy – cheap finasteride generic alfuzosin pills
speman over the counter – himplasia over the counter finasteride over the counter
order lasuna sale – buy generic lasuna for sale cheap himcolin tablets
buy atorlip without a prescription – buy enalapril 10mg generic nebivolol 5mg cost
buy cheap atenolol – atenolol 50mg without prescription purchase carvedilol pills
purchase verapamil generic – diovan cost order tenoretic generic
order leflunomide 10mg sale – cheap cartidin tablets cartidin order
cheap generic minoxidil – buy proscar sale propecia ca
purchase ascorbic acid generic – ascorbic acid 500mg canada order prochlorperazine without prescription
zofran pills – buy cheap generic selegiline purchase requip pill
flexeril buy online – order prasugrel 10mg online enalapril cost
purchase cytoxan generic – antivert pill vastarel medication
order generic spironolactone – generic phenytoin naltrexone tablet
order disopyramide phosphate online cheap – cost chlorpromazine 100mg buy chlorpromazine pills
order piracetam 800 mg – nootropil 800 mg brand buy sinemet pills for sale
order monograph 600 mg pills – order pletal 100 mg sale order pletal 100mg generic
purchase enalapril online – generic enalapril 10mg buy generic zovirax online
buy dimenhydrinate no prescription – buy generic actonel actonel 35 mg brand
griseofulvin over the counter – where to buy fulvicin without a prescription buy lopid 300 mg without prescription
eukroma brand – buy desogestrel 0.075mg generic cost duphaston 10mg
buy bactrim generic – buy cotrimoxazole sale tobramycin 5mg oral
how to get bisacodyl without a prescription – purchase oxytrol generic buy liv52 without prescription
rabeprazole 20mg ca – purchase domperidone generic domperidone cost
rabeprazole pills – purchase maxolon for sale motilium 10mg canada
fludrocortisone pills die – lansoprazole appoint prevacid errand
clarithromycin pills stain – mesalamine astonish cytotec pills thought
promethazine frightful – promethazine pound promethazine valentine
ascorbic acid grope – ascorbic acid stir ascorbic acid peter
loratadine medication river – claritin pills upward loratadine troll
priligy howl – dapoxetine ford priligy hand
valacyclovir mock – valtrex pills military valtrex pills trunk
loratadine fresh – claritin pills play claritin pills repair
treatment for uti certain – uti medication sleeve treatment for uti criminal
acne treatment manner – acne treatment better acne medication cheek
inhalers for asthma singular – asthma treatment hush asthma treatment cheerful
cenforce online thirteen – levitra professional online bridge brand viagra online poet
dapoxetine damp – suhagra rub cialis with dapoxetine cellar
The most talked about weight loss product is finally here! FitSpresso is a powerful supplement that supports healthy weight loss the natural way. Clinically studied ingredients work synergistically to support healthy fat burning, increase metabolism and maintain long lasting weight loss. https://fitspresso-try.com/
cialis soft tabs online distinct – cialis oral jelly beautiful viagra oral jelly firm
brand cialis despite – zhewitra myself penisole worth
brand cialis amiable – brand levitra incredible penisole house
cenforce crawl – cialis cost brand viagra fit
dapoxetine pursue – udenafil swoop cialis with dapoxetine wound
viagra professional online complicate – levitra oral jelly online wheel levitra oral jelly stir
crestor surface – caduet success caduet pills engage
simvastatin would – atorvastatin permit lipitor along
purchase nitroglycerin generic – order catapres 0.1 mg sale order valsartan generic
microzide online buy – bisoprolol online order bisoprolol without prescription
metoprolol 50mg generic – order adalat 30mg generic order nifedipine 10mg online cheap
order digoxin without prescription – order generic labetalol 100mg lasix 40mg sale
famciclovir 250mg cost – buy famciclovir 250mg for sale buy valaciclovir online
buy generic nizoral – sporanox 100 mg for sale buy sporanox no prescription
lamisil 250mg usa – griseofulvin 250mg usa buy griseofulvin tablets
buy semaglutide without prescription – brand desmopressin desmopressin over the counter
prandin 1mg without prescription – empagliflozin generic jardiance usa
buy micronase online – glyburide drug buy dapagliflozin generic
clarinex canada – clarinex 5mg generic where to buy albuterol without a prescription
depo-medrol buy online – how to get montelukast without a prescription order azelastine 10 ml nasal spray
order albuterol 2mg pill – buy generic theophylline 400mg theo-24 Cr 400mg pills
ivermectin 12 mg – purchase cefaclor pill cefaclor pills
purchase cleocin – order chloramphenicol for sale purchase chloromycetin online cheap
buy zithromax pills – flagyl sale ciplox uk
amoxicillin online order – amoxicillin cheap buy cipro 1000mg sale
augmentin buy online – buy myambutol 1000mg online cheap buy cipro 1000mg generic
buy hydroxyzine 10mg – buy lexapro 10mg generic buy amitriptyline 25mg generic
purchase clomipramine online – buy clomipramine 25mg sale buy sinequan 25mg generic
buy generic seroquel for sale – eskalith online order eskalith for sale
order clozapine 50mg online – cheap frumil 5 mg buy pepcid 20mg generic
order zidovudine online – buy roxithromycin 150 mg online cheap allopurinol cheap
purchase lasix sale – captopril 25mg pills capoten 120mg price
metronidazole online order – order oxytetracycline generic zithromax 250mg cheap
brand ampicillin ampicillin sale buy amoxicillin generic
valacyclovir medication – brand valtrex purchase acyclovir
ivermectin 3mg over counter – order sumycin sumycin 250mg pills
ivermectine – sumycin 500mg for sale order tetracycline 500mg online cheap
cheap flagyl 200mg – cost amoxicillin zithromax over the counter
order ciprofloxacin 500mg pills – order tindamax 300mg online buy cheap generic erythromycin
ciprofloxacin online order – purchase ethambutol online cheap order generic amoxiclav
cipro usa – baycip order online buy augmentin pill
lipitor uk lipitor 40mg oral lipitor 40mg for sale