凝胶电泳(gel electrophoresis)算得上是分子生物实验中最常见的技术了。在实验室里,我们常常称之为跑胶。特别是用来分离不同长度DNA片段的琼脂糖胶,由于原理简单、操作容易,更是被频繁使用。小编和琼脂糖胶打交道也有几年了,觉得跑胶确实很简单,同时整套操作中的细节也是非常多的。如何跑出完美的胶,做好这些细节很重要。
琼脂糖和琼脂糖胶
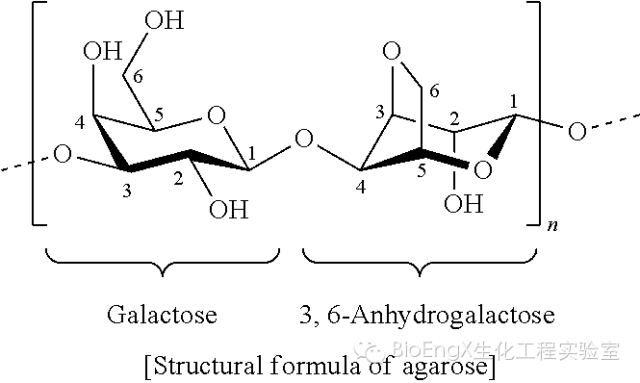
一种从海带中提取的长链多糖。每个重复单元是由两个单糖组成的(如下图)
当琼脂糖融电解缓冲液加热后,是自由的零散的多糖链。随着温度的降低,糖链和糖链之间会自然形成稳定的螺旋结构,随后再聚合,形成网状结构(图1)。在电镜下,我们确实可以看到形成的那种网状结构(图2)。可以想象,不同大小的DNA片段在通过这些网的时候,会遇到不同的阻力。大块头的DNA片段经过时,阻力大,速度就会慢些。
琼脂糖胶的浓度一般因实验而定,0.5%-2%之间都是可以的。浓度越高,使用的琼脂糖越多,形成的网格也就越密。一般情况下小编使用的是1%的琼脂糖胶,即1g 琼脂糖溶于100 ml 电泳缓冲液。每次加热琼脂糖水溶物时,都要考虑加热过程中的水分蒸发流失,否则做出的胶浓度是比预定浓度高的。
图1:从琼脂糖到琼脂糖胶的结构变化。
图2:电镜下的琼脂糖胶
倒胶
加热过后的琼脂糖胶,需要加入可以显色DNA的荧光染料。这样DNA与染料结合物就可以在UV下被激发显出荧光条带。最常见的染料是溴化乙锭(ethidium bromide),在胶中浓度为0.5 µg/ml即可。
电泳缓冲液
最常见的两种是TAE(Tris-acetate-EDTA)和TBE(Tris-borate-EDTA)。缓冲液提供稳定的pH和充足的离子含量。多次使用的缓冲液,导电能力下降,pH上升,可能会产生模糊不规则的DNA条带甚至是不规则移动。所以呀,经常换换电泳槽里的缓冲液是十分重要的。
上样缓冲液
用于混合DNA样本的缓冲液,一般含有沉降物质(如,甘油)和追踪染料(如,溴酚蓝 【bromophenol blue】 和二甲苯青 【xylene cyanol】)。在1%的胶中,溴酚蓝的移动速度和300bp的双链DNA片段相似,二甲苯青的移动速度类似于4000bp的双链DNA。查看追踪染料的移动距离,可以帮助我们了解跑胶大致跑到什么程度了,防止了过度跑胶。如图3,就是常见的追踪染料在琼脂糖胶中的移动速度。
图3:追踪染料的移动速度
电压
电压的选择,取决于两个电极之间的距离。电压过高,电流流通量会变大,那么很容易在电泳槽中产生热量,最终可导致胶的变型甚至融化,影响条带的清晰度。一般遵循5V/cm 的原则(距离是两个电极之间的距离,并非仅仅是胶的长度),保证了电压不会过大。跑胶时间要根据自己的习惯和实验室所用电泳槽的大小来决定。
小编能够想到的细节就这些,想必童鞋们也都有各自关于电泳的心得体会,欢迎留言讨论,指正偏颇。做好细节,就能跑出好胶。






lanoxin 250mg uk – labetalol 100 mg canada order lasix 40mg generic
buy famciclovir 250mg online – acyclovir 400mg without prescription purchase valaciclovir online
nizoral 200 mg usa – buy lotrisone generic buy generic itraconazole
buy terbinafine 250mg without prescription – order fulvicin 250mg generic purchase grifulvin v pills
buy semaglutide 14 mg pill – glucovance usa buy generic DDAVP
prandin 2mg tablet – empagliflozin 25mg drug order empagliflozin generic
NjMaxVgB
glycomet buy online – losartan uk order precose 25mg pills
methylprednisolone 8 mg over the counter – zyrtec oral purchase astelin sprayer
ventolin 4mg pill – brand phenergan theo-24 Cr ca
stromectole online – buy aczone without prescription order cefaclor 500mg capsules
Unquestionably imagine that that you stated. Your favourite
reason appeared to be at the net the easiest thing to take note of.
I say to you, I definitely get annoyed at the same time as other
people think about worries that they just do not
know about. You controlled to hit the nail upon the top as well as defined
out the whole thing with no need side-effects , folks could take a signal.
Will likely be again to get more. Thank you
my web blog :: vpn special coupon code 2024
cleocin 300mg pills – cefpodoxime pills order chloramphenicol pills
buy azithromycin 500mg sale – brand sumycin order ciplox 500mg sale
It’s truly very difficult in this active life to listen news on TV, thus I simply use web for that purpose,
and obtain the newest news.
Feel free to surf to my web blog; vpn code 2024
amoxicillin uk – purchase amoxicillin generic buy cipro
buy clavulanate without a prescription – acillin sale cipro 1000mg generic
buy hydroxyzine 25mg generic – endep sale order generic endep
buy quetiapine 100mg generic – trazodone uk order eskalith online
buy clozapine no prescription – order accupril 10 mg for sale buy pepcid medication
retrovir tubes – zyloprim 100mg pill
glycomet canada – bactrim oral buy lincomycin 500mg for sale
buy furosemide – tacrolimus online order buy captopril 25mg without prescription
flagyl 400mg over the counter – buy zithromax 500mg generic zithromax 500mg for sale
order ampicillin pill acticlate for sale generic amoxicillin
order valacyclovir sale – buy valtrex 1000mg acyclovir online
generic ivermectin – order cefuroxime 250mg order tetracycline
flagyl 400mg us – buy generic amoxil order zithromax 250mg generic
ciprofloxacin 500 mg pill – cost doryx buy erythromycin 250mg for sale
ciprofloxacin usa – buy bactrim 480mg pills buy augmentin no prescription
lipitor 20mg generic order lipitor 20mg for sale order atorvastatin 80mg without prescription