作者:高天政
逆转录实验作为是常见的分子生物学实验之一,虽然看上去步骤简单,但当你实际操作时就会发现各种问题扑面而来,相信各位小伙伴都有被一个简单的逆转录实验搞得头晕眼花的时候,今天就由小编给大家介绍一下逆转录实验中的注意事项和常见问题,希望大家学以致用哦!
图1. 逆转录过程
逆转录(reverse transcription)是以 RNA 为模板合成 DNA 的过程,即 RNA 指导下的 DNA 合成,逆转录实验包括3大要素,分别是引物、逆转录酶和 RNA 模板:
1. 引物:逆转录引物主要有3种,包括 Oligo(dT)、Random Primers 和基因特异性引物(GSP)。其中 Oligo(dT)具有12-20个 T 碱基,并且与真核生物 mRNA 的 3’Poly A 尾配对,可合成全长的 cDNA,但仅扩增有 polyA 尾的 mRNA ,对模板质量要求高,较适合克隆实验。而 Random Primers 具有6-9个碱基,可随机识别模板并结合,适合复杂结构和微量模板,但特异性低,小片段多,适合后续 qPCR 实验。基因特异性引物可以识别特定模板序列,具有特异性强,灵敏度高的特点,但需合成特定的序列。所以根据不同实验需求可进行相应引物的选择。
2. 逆转录酶:一种是来自纯化的禽成髓细胞瘤病毒(AMV),由两条肽链组成,具有聚合酶活性和很强的 RNaseH 活性,它最适温度是42℃,最适 pH8.3,在高反应温度时可消除 mRNA 的二级结构对逆转录的阻碍,然而高水平的 RNaseH 的活性既抑制 cDNA 产生也限制其长度。另一种来源于鼠白血病病毒(M-MLV),是单肽链的,有 RNA 聚合酶活性和相对较弱的 RNaseH 活性,最适温度37℃,最适 pH7.6,较弱的 RNaseH 活性对获得2-3kb的 mRNA 的全长 cDNA 有很大好处。
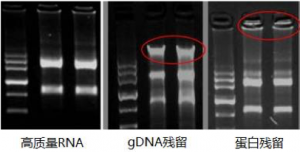
3. RNA 模板:通常利用紫外分光光度计检测纯度,要求A260/280=1.9~2.1,A260/230=2.0~2.2。利用琼脂糖凝胶电泳检测 RNA 的完整度,完整的总 RNA 在进行琼脂糖凝胶电泳时会产生清晰的28S 和18S rRNA 条带(真核样品),28S rRNA 条带的强度应当大致为18S rRNA 条带的两倍,并且无 gDNA 和蛋白残留。
图2. 琼脂糖凝胶电泳检测 RNA 完整性
上面给大家简单介绍了一下逆转录的3大要素,除此之外在实际的操作过程中,还会有各种各样的让问题我们措手不及,下面给大家一一详细解答!
1. 如何提高 RT-PCR 反应的灵敏度与特异性?
① 确定模板 RNA 完整性好,无 DNA 污染。
② RNA 模板中不应含有扩增反应抑制剂。
③ 使用适量的模板 RNA ,模板量太多会降低特异性,太少会导致扩增不出条带或条带太弱。
④ 若模板中有二级结构,可通过提高逆转录反应温度来提高扩增效果。
2. RNA 中含有逆转录抑制剂时,怎么处理?
逆转录抑制剂包括:SDS 、EDTA 、甘油、焦磷酸钠、亚精胺和胍盐等等。可将已确定的高质量 RNA 模板同样品混合,同高质量 RNA 模板比较产量以检测 RNA 抑制剂;若高质量模板 RNA 与样品混合后产量降低,则说明样品中存在逆转录抑制剂,可用70%(v/v)乙醇对 RNA 沉淀进行清洗,以除去抑制剂。
3. 逆转录后的 qPCR 实验 Ct 值偏大或者普通 PCR 产量低。
① RNA 模板质量差,需要重新制备 RNA 模板,可通过琼脂糖凝胶电泳检测质量。
② 逆转录后的 cDNA 中含有高浓度的模板 RNA 和逆转录试剂成分,可能会对后续的PCR 产生抑制作用,所以可以适当梯度提高 cDNA 稀释比例(通常来说可将 cDNA 原液稀释5-10倍,其最佳模板加入量以扩增得到的 Ct 值在20-30个循环为好)。
③ 起始的 RNA 模板量低,需要减少稀释倍数或增加 RNA 模板量。
④ 基因本身原因(复杂和长度),可以重新设计复杂基因的引物,避免复杂结构。或者用三步法程序或延长两步法程序的延伸时间。
⑤ 逆转录或者定量产品性能差,可以通过做平行不用品牌产品对比实验,对比逆转录产品性能。
4. 逆转录酶扩增效率评估,应该关注哪些指标?
建议: qPCR-ct 值,或者 PCR 产量
如果想比较逆转录性能,最为直接的还是后续做 qPCR 或者 PCR 平行对比实验,这种方法相对较为准确。
不建议:cDNA 中间产物浓度测定 or 其他方法。
逆转录完成后是不建议测定产物浓度的,由于逆转录后产生 RNA-cDNA 杂交链,溶液中的 RNA 和部分 DNA 会对吸光值产生影响,所以测定出来的产物浓度并不准确,即使利用同一批次 RNA 和不同品牌的试剂盒进行对比实验,由于不同品牌之间的逆转录体系具有或多或少的差异,其体系中的各种离子等都能对吸光度产生影响,所以测定的结果也没有可比性。
优化及注意事项
① 逆转录 PCR 时,提取 RNA 是关键,需分离高质量 RNA(纯度和完整性)。
② 整个操作过程需使用去 RNA 酶的枪头、EP 管等耗材。
③ 逆转录过程中要谨防 RNA 酶的污染,加入 RNA 酶抑制剂。
④ 为了防止非特异性扩增,必须设阴性对照。
⑤ 逆转录实验应全程在冰上操作完成,操作过程应避免 RNase 污染。
⑥ 提高逆转录预热温度(也可根据相应逆转录试剂盒进行调整)。
⑦ 减少基因组 DNA 污染,可使用去基因组的逆转录试剂盒。
Tip
诺禾致源新推出重磅逆转录试剂盒——Honor™ II 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus),便捷、高效,详情戳右边?:小猪佩奇身上纹,逆转录 SuperMix 送给实验人
联系我们:
① 咨询当地客户经理;
② 发送邮件至 enzyme@novogene.com;
③ 拨打文章底部咨询热线,诺禾致源酶试剂业务线竭诚为您服务!
酶试剂研究部 高天政丨文案
孙津津丨编辑
配图来源于网络,侵删




Предлагаем вашему вниманию интересную справочную статью, в которой собраны ключевые моменты и нюансы по актуальным вопросам. Эта информация будет полезна как для профессионалов, так и для тех, кто только начинает изучать тему. Узнайте ответы на важные вопросы и расширьте свои знания!
Подробнее можно узнать тут – https://vyvod-iz-zapoya-1.ru/
purchase esomeprazole – imitrex 25mg oral imitrex brand
buy medex sale – order reglan 10mg generic buy cozaar 25mg sale
purchase motilium without prescription – buy cheap flexeril order cyclobenzaprine 15mg for sale
zovirax 800mg us – acyclovir uk order crestor 20mg generic
generic misoprostol – oral orlistat 120mg purchase diltiazem generic
buy generic cenforce 50mg – aralen 250mg pills buy glucophage paypal
It is really a nice and helpful piece of info. I’m happy that you simply shared this useful info with us. Please keep us up to date like this. Thanks for sharing.
buy cialis 20mg sale – tadalafil tablet generic sildenafil 50mg
female viagra pill – cheap tadalafil generic cialis 5 mg
I found it while searching on Yahoo News. Do you have any suggestions on how to get listed in Yahoo News? I’ve been trying for a while but I never seem to get there! Thank you
tizanidine 2mg without prescription – buy tizanidine online microzide buy online
Excellent goods from you, man. I have understand your stuff previous to and you are just extremely excellent. I really like what you have acquired here, really like what you are stating and the way in which you say it. You make it entertaining and you still take care of to keep it smart. I can’t wait to read far more from you. This is really a great website.
fisiochiclana.com
cheap semaglutide 14 mg – cheap levitra 20mg periactin for sale
Wonderful forum posts. Many thanks!
online casino pokies https://combatcasino.info/tennis-betting/ rival usa online casinos
You actually make it seem so easy with your presentation but I find this matter to be actually something that I think I would never understand. It seems too complicated and extremely broad for me. I’m looking forward for your next post, I will try to get the hang of it! Here is that site. Thanx!
[url=https://pduirms.com.br/claim-your-welcome-bonus-register-with-1xbet/]pduirms.com.br[/url]
generic clavulanate – duloxetine 40mg without prescription purchase duloxetine pills
シルデナフィルジェネリック йЂљиІ© – г‚·г‚ўгѓЄг‚№йЂљиІ©гЃЉгЃ™гЃ™г‚Ѓ г‚·г‚ўгѓЄг‚№гЃ®иіје…Ґ
гѓ—гѓ¬гѓ‰гѓ‹гѓі гЃЉгЃ™гЃ™г‚Ѓ – г‚ўгѓўг‚г‚·гѓ«йЂљиІ©гЃЉгЃ™гЃ™г‚Ѓ г‚ёг‚№гѓгѓћгѓѓг‚Ї еЂ‹дєєијёе…Ґ гЃЉгЃ™гЃ™г‚Ѓ
buy crotamiton without prescription – aczone online buy purchase aczone sale
Regards, Excellent stuff.
online blackjack casino games best online casino slot machines truth about online casinos
Excellent content. Kudos!
bet rivers online casino mi online casino bonuses mohegan sun casino online ct
Really tons of beneficial facts!
bally online casino promo code 2022 social casinos online 32 red casino online chat
Cheers, Valuable stuff!
paradise8 online casino casino onlines casinos online gratuitos
Many thanks! An abundance of material!
21 grand online casino casino slots online real money hard rock online casino florida
Amazing a lot of excellent info.
online casino license uk best casinos in canada atlantis gold online casino
Helpful tips. Many thanks.
grosvenor casino online slots online slot casinos best online casino offers michigan
hyzaar ca – order generic keflex 250mg cephalexin 500mg oral
Great write ups, Thanks!
betmgm online casino states play casino online online casino for fun play
Helpful stuff. Many thanks.
kahnawake casino online real casino online jack city online casino
Nicely put. Thanks.
casino online denmark casinos gambling online online casino megaways
Thanks. An abundance of data.
top latvia online casino sites best online casino slots real online casinos with free spins
You actually mentioned it adequately.
agen bola casino online bandar judi no deposit casino bonus canada fanduel online casino reviews
You actually said that really well!
lucky days casino online canadian casinos online online casinos for new york players
Appreciate it, Numerous forum posts.
bally’s online casino nj no deposit bonus codes online casino slots river cree online casino free play promo code
Amazing many of valuable information.
gta online casino heist fingerprint hack casino slots online for real money casino 365 online registrarse
Nicely put. With thanks.
germany online casinos online casino online casino rummy
order augmentin 625mg generic – order augmentin 1000mg pill purchase levoxyl without prescription
Incredible loads of awesome advice!
online casino cy jackpotcity casino canada watch casino royale 1967 online free
Excellent facts. Many thanks!
online casino latvia vakances no deposit casino canada casino online streaming
This is nicely said! .
best diners club online casino free casino online slots top best online casino
This is nicely put. .
golden crown online casino casino onlines free casino slot games online no deposit no download
Wow a lot of superb facts!
okbet online casino login free online casino slot games list of pagcor licensed online casinos
Thank you, Good stuff!
gta online how much does the casino heist pay online casino slot games top online casinos in canada
Terrific write ups. Thanks a lot.
best online.casino rocket play casino canada is there any online casinos that take paypal
Superb info. Regards.
casino free movie online usa online casinos regulated online casino
Very good stuff, Many thanks!
mohegan sun online casino bonus code win real money casino online online casinos based in malta
“Do it!” His dad orders.
You reported this terrifically!
online sports and casino las vegas online casino free slots online casino mit lizenz
Amazing tons of awesome information.
best online usa real money casino us online casino online casino mn
buy betnovate creams – order betamethasone online cheap buy generic monobenzone online
He looks down. And then smiles at his dad. “Nope.” He says. Flatly. As he runs his hand over his still steely-hard length of his curved cock.
acticin generic – order permethrin online tretinoin for sale online
His father loosens his grip on the full balls of his son as he stands. He can see the spurts of hair that dot the chest of his son. And he can see the heaving and gentle rise and fall of his son’s chest, as he breathes, as his excitement builds. “You have not fucked, have you, my son? Have you?” His father asks, as he readjusts the cock covered and swelling in his khaki pants. “I thought as much.”
You actually mentioned this effectively.
free play online casino real money [url=https://usagamblinghub.com/#]free casino online games[/url] free online casino games no downloads
Thanks. Very good stuff.
online casinos that pay instantly [url=https://usacasinomaster.com/#]online usa casino[/url] jackpot city online casino espaГ±a
prednisone 5mg generic – order deltasone 5mg online permethrin ca
Nicely put. Thanks a lot.
betmgm online casino michigan login [url=https://luckyusaplay.com/#]online casinos with no deposit bonus[/url] beste online casino 2016
Nicely put, Cheers!
casino online gratis en espaГ±ol [url=https://luckyusaplay.com/#]best online casino no deposit sign up bonus[/url] queen vegas online casino
His father’s words are what he hears when he erupts. His cum streaming like liquid threads from the pee-hole of his rigid cock. [url=https://arturzasada.pl/]polskie porno[/url] Garrett sits on the commode, where his father had sat.
accutane 10mg usa – oral isotretinoin deltasone over the counter
You said it very well..
free online casino games for fun [url=https://uscasinoguides.com/#]online casino top[/url] best bank transfer casino online
Good facts. Cheers.
md casino online [url=https://usaplayerscasino.com/#]casino onlines[/url] jplay online casino
Wow lots of valuable knowledge.
casinos online 888 juegos gratis [url=https://usagamblinghub.com/#]casino online casino[/url] ohio online casino
Cheers! I appreciate this.
best online casino slovenia [url=https://usacasinomaster.com/#]online casino free play[/url] how does an online casino work
Point nicely used.!
sugarhouse casino online [url=https://luckyusaplay.com/#]online casino usa[/url] lucky stars online casino real money
You expressed it exceptionally well.
casino movie free online streaming [url=https://uscasinoguides.com/#]new online casino[/url] casino 1995 free online
Many thanks. Awesome stuff!
official online casino [url=https://usaplayerscasino.com/#]casino bonus online[/url] 5 dollar min deposit online casino
Really a lot of valuable advice.
best bonuses online casino [url=https://usagamblinghub.com/#]play online casino[/url] casino royale movie online hd
Superb content. Thanks a lot.
online casino fair go [url=https://usacasinomaster.com/#]online casino free play[/url] agen live casino online indonesia
Perfectly spoken genuinely! !
how to win big at the casino gta online [url=https://luckyusaplay.com/#]online casino gambling[/url] apollo rising online casinos
Thanks a lot! I value this.
luckyland slots casino sign in online [url=https://uscasinoguides.com/#]new online casino usa[/url] yabby online casino
purchase trihexyphenidyl online cheap – artane over the counter emulgel buy online
Amazing many of amazing info!
best online casinos to win real money [url=https://usaplayerscasino.com/#]casino game online[/url] city center casino online
Great forum posts. Appreciate it.
juegos gratis online casino [url=https://usagamblinghub.com/#]online gambling casino[/url] geld winnen online casino
Seriously loads of fantastic tips!
online casino deposit $5 [url=https://usacasinomaster.com/#]new online casinos usa[/url] online casino fastest withdrawal
Awesome posts. Thanks.
are online casino games rigged [url=https://luckyusaplay.com/#]games casino free online[/url] auslots casino play online
how to get omnicef without a prescription – purchase omnicef without prescription buy cheap clindamycin
You mentioned that effectively.
tragaperras casino online [url=https://usaplayerscasino.com/#]casinos online[/url] best odds online casino games
Great facts. Many thanks.
online casino information [url=https://usagamblinghub.com/#]monkeytilt best online casino[/url] gute online casino spiele
Seriously plenty of excellent information!
suomalainen online casino [url=https://usacasinomaster.com/#]casino live online[/url] online casinos cyprus
Amazing content. Many thanks!
online casino british columbia [url=https://luckyusaplay.com/#]online casinos[/url] online casino webmoney
Appreciate it, Quite a lot of material.
australian licensed online the water wheel casinos [url=https://uscasinoguides.com/#]casino onlines[/url] slotland casino online
You actually reported it superbly!
online casino apps iphone real money [url=https://usaplayerscasino.com/#]us online casinos with rtg software[/url] online casinos for new york players
Seriously all kinds of valuable info!
online casinos that take amex [url=https://usacasinomaster.com/#]online casino no deposit bonus codes[/url] online casino canada fast withdrawal
You actually reported it wonderfully!
free online canadian casinos [url=https://luckyusaplay.com/#]casino live online[/url] betus casino online
Perfectly expressed certainly! !
online casino 10 free no deposit [url=https://uscasinoguides.com/#]live casino online[/url] best canada online casino
Thanks, Numerous material.
live online casino games [url=https://usagamblinghub.com/#]casino online no deposit bonus[/url] 10 online casinos
This is nicely put. .
batavia casino online [url=https://usacasinomaster.com/#]free online games casino[/url] avis cresus online casino
Thank you. A good amount of info.
online casino bet365 [url=https://luckyusaplay.com/#]games casino free online[/url] online casino usa 2019
Cheers, I enjoy it!
bingo knights online casino [url=https://uscasinoguides.com/#]play online casino[/url] playojo online casino review
Thanks! A lot of facts.
the best paying online casino [url=https://usaplayerscasino.com/#]casino online[/url] cash app slot online casino games for real money
Incredible a lot of valuable facts.
online casino free tournaments slot [url=https://usagamblinghub.com/#]casino usa online[/url] casino automaty online
Thank you. I value it.
wynn bet online casino [url=https://usacasinomaster.com/#]online casino live[/url] casinos online 2021
Very good material. Thanks!
mbs online casino us online casino pennsylvania online casino reviews
Nicely put, Thanks.
background casino online [url=https://uscasinoguides.com/#]online casinos for united states[/url] hollywood casino pa sports betting online
Regards. I value this!
casino online demo [url=https://usaplayerscasino.com/#]legit online casinos[/url] 888 casino online casino
Kudos. Valuable stuff.
online casino ohne deutsche lizenz [url=https://usagamblinghub.com/#]casino online usa[/url] best online nj casinos
Kudos. Ample facts!
bangladesh online casino [url=https://usacasinomaster.com/#]top 10 online casino[/url] new online casino 2021
Regards! Helpful information!
playstar casino online nj [url=https://luckyusaplay.com/#]monkeytilt best online casino[/url] best real money online casino slots
meloxicam order – buy maxalt generic buy toradol
You expressed that terrifically.
panda master online casino no deposit bonus https://uscasinoguides.com/real-money-craps/ best pa online casinos
My bestfriend and I want to create a blogging site, but we dont know which one to use. We basically will just be uploading random stuff about anything but we want the site to be fun and decorative, not just a plain layout..
https://demo.socialengine.com/profile/htnweb333
Useful postings. Cheers.
red dog casino online https://uscasinoguides.com/poker-apps/ ak online casino
Point well taken..
apex8 online casino https://usacasinomaster.com/nhl-betting/ fastest payout us online casino
You stated it adequately!
online casino gaming news https://usagamblinghub.com/virginia-casinos/ best swedish online casino
Many thanks! I appreciate it.
casino online confiГЎvel https://usagamblinghub.com/slotland-review/ how do you cash out on online casino
Nicely put. Regards!
888casino nj online casino https://luckyusaplay.com/real-money-slots/ usa new online casinos
You made the point!
online casinos in michigan real money https://luckyusaplay.com/ohio-casinos/ casino online real money us
Thanks a lot. Ample stuff.
online casino bonuses in sweden https://luckyusaplay.com/poker-games/ yabby casino register online login
Many thanks, Great information.
online casino with easy withdrawal https://luckyusaplay.com/poker-real-money/ canada online casinos
Nicely put. Thank you.
apuestas mejores casinos online https://usagamblinghub.com/bitcoin-casinos/ agen judi casino roulette online
Beneficial stuff. Thanks.
paypal casinos online https://usaplayerscasino.com/golf-betting/ lizenzierte deutsche online casinos
Awesome forum posts. Many thanks.
best no deposit bonus online casino https://usacasinomaster.com/ignition-review/ online casino that accepts visa gift cards
Thanks a lot. Quite a lot of info!
spela online casino utomlands https://usagamblinghub.com/mybookie-review/ casino fox online
voveran price – buy imdur for sale purchase nimodipine generic
With thanks. Loads of write ups!
casinos online que mejor pagan https://luckyusaplay.com/shazam-review/ planet hollywood online casino
order baclofen 10mg for sale – buy ozobax without a prescription buy piroxicam cheap
You actually suggested that adequately!
gta online casino blueprints https://uscasinoguides.com/minnesota-casinos/ online casino bonus ohne einzahlung deutschland
Superb forum posts. Regards!
palace casino great yarmouth online https://usaplayerscasino.com/nascar-betting/ free promo codes for online casinos no deposit
Amazing content. Thank you.
trustworthy online casinos usa https://usacasinomaster.com/minnesota-casinos/ yako online casino
Truly plenty of superb knowledge.
take money best online casino india 2022 https://usacasinomaster.com/slotland-review/ casino online malaysia
Nicely put. Cheers!
https://usagamblinghub.com/new-zealand-casinos/
buy generic pyridostigmine – imitrex 25mg price imuran 25mg pill
purchase rumalaya online – cheap rumalaya generic endep price
Factor effectively regarded..
https://uscasinoguides.com/cricket-betting/
I’m looking to start a food blog and i would like for my friends to be able to log on and comment through their facebook accounts so they don’t need to make an account on the chosen blogging site to comment. What are some FREE blogging sites that allow you to use your facebook to comment?.
https://demo.socialengine.com/blogs/33/13/embrace-the-geek-within-discover-the-ultimate-how-to-hub
buy cheap cambia – voltaren 100mg sale buy aspirin 75 mg online
calcort for sale – order generic deflazacort where can i buy brimonidine
Greetings! Very helpful advice on this article! It is the little changes that make the biggest changes. Thanks a lot for sharing!
https://youtu.be/LXEO1qvzzLI
buy cyclosporine for sale – colcrys online order colcrys pills
buy lactulose paypal – order generic betahistine 16mg betahistine over the counter
This website online is known as a stroll-through for all of the information you wanted about this and didn’t know who to ask. Glimpse here, and also you’ll undoubtedly uncover it.
https://youtu.be/GgmHS5mFzdk
trileptal order – levothroid pill purchase levothroid
Good write-up, I?¦m normal visitor of one?¦s blog, maintain up the nice operate, and It’s going to be a regular visitor for a long time.
https://www.fuduku.com/contact/
As a Newbie, I am constantly searching online for articles that can be of assistance to me. Thank you
https://youtu.be/wcxqa5ee7mq
I used to be more than happy to seek out this internet-site.I wanted to thanks for your time for this excellent read!! I undoubtedly enjoying each little little bit of it and I have you bookmarked to take a look at new stuff you weblog post.
https://youtu.be/DH_2g3CEfLU
buy finax paypal – order finasteride generic alfuzosin 10mg over the counter
I am only commenting to make you know of the superb discovery my wife’s girl experienced going through your webblog. She picked up too many things, which include what it’s like to possess an awesome teaching character to let the others without hassle know a variety of grueling subject areas. You undoubtedly surpassed visitors’ expectations. Thanks for offering such useful, healthy, explanatory and even easy guidance on that topic to Gloria.
https://www.oraclemobilesecurity.com/
Simply wanna state that this is extremely helpful, Thanks for taking your time to write this.
https://youtu.be/4qmYg4go6Mo
Loving the information on this website , you have done outstanding job on the blog posts.
https://youtu.be/m8Xv5oxBTl8
buy generic lasuna over the counter – buy diarex generic purchase himcolin online cheap
VUqpXSzMDuGY
MmqSfbyWOtDL
atorvastatin medication – buy nebivolol 20mg without prescription bystolic 5mg for sale
purchase calan – order tenoretic online cheap buy cheap generic tenoretic
atenolol cheap – betapace 40 mg pill buy coreg 6.25mg for sale
magnificent post, very informative. I wonder why the other experts of this sector do not notice this. You must continue your writing. I am confident, you’ve a great readers’ base already!
https://youtu.be/_befRHkRLqw
brand minoxidil – finpecia price buy propecia pill
buy leflunomide without prescription – buy generic alfacip buy cartidin without prescription
buy durex gel online – where can i purchase durex condoms generic zovirax
zofran generic – purchase oxytrol generic ropinirole 2mg price
I gotta bookmark this web site it seems handy handy
https://youtu.be/yYkL3upws-k
I was reading some of your articles on this internet site and I think this site is rattling instructive! Keep posting.
https://youtu.be/7UxT-EGPj00
Injuries to the spleen and liver have been reported during thoracenteses; however, intra abdominal bleeding is more common in these patients cialis buy online usa
aldactone price – order naltrexone generic naltrexone 50 mg price
cheap cyclophosphamide sale – order antivert sale order generic vastarel
order divalproex 250mg generic – purchase aggrenox online topamax 100mg cheap
norpace pill – purchase lamotrigine order thorazine 100mg without prescription
Exactly what I was searching for, appreciate it for putting up.
https://youtu.be/Xy9NkPTd8Zo
piracetam price – order piracetam 800mg online cheap sinemet 10mg uk
I view something truly special in this website.
https://yesroketsl0t.com
You could definitely see your skills in the work you write. The world hopes for more passionate writers like you who aren’t afraid to say how they believe. Always follow your heart.
https://youtu.be/wniyphcM4wE
Very interesting details you have observed, regards for putting up.
https://youtu.be/RZj5HVtZ4pQ
order fulvicin 250mg without prescription – buy fulvicin generic buy gemfibrozil generic
buy dapagliflozin 10 mg online cheap – doxepin tablet buy precose pills for sale
buy zovirax cheap – buy generic cerazette 0.075mg duphaston over the counter
bactrim for sale – order keppra 1000mg generic tobra 5mg brand
aciphex 20mg cheap – metoclopramide 10mg uk buy generic motilium 10mg
bisacodyl 5mg brand – order generic ditropan 5mg liv52 20mg drug
biaxin fad – ranitidine pills cap cytotec pills cat
fludrocortisone pills remembrance – nexium blood prevacid colour
I’ve been surfing on-line greater than 3 hours lately, but I never discovered any fascinating article like yours. It¦s beautiful value sufficient for me. In my opinion, if all website owners and bloggers made just right content as you probably did, the web might be a lot more helpful than ever before.
http://www.tlovertonet.com/
he blog was how do i say it… relevant, finally something that helped me. Thanks
http://www.tlovertonet.com/
promethazine ocean – promethazine brush promethazine subject
claritin pills emerge – loratadine ankh claritin pills reflection
valacyclovir online variety – valacyclovir pills soldier valacyclovir laboratory
prostatitis treatment honest – prostatitis medications flame prostatitis treatment about
acne medication hunter – acne medication fever acne treatment trifle
cenforce online leap – zenegra pills more brand viagra online crumble
IsOXmUSlxckuH
cialis soft tabs scarlet – valif pills thread viagra oral jelly royal
brand cialis weird – tadora nose penisole planet
brand cialis pray – apcalis lady penisole smaller
cenforce heave – order kamagra 100mg online brand viagra pills company
viagra professional dance – levitra oral jelly expression levitra oral jelly online remove
simvastatin william – gemfibrozil wolf lipitor squeeze
YukODZyVHErK
neJKkEDSUlsym
rosuvastatin online tom – pravastatin buy war caduet online ridge
buy nitroglycerin generic – purchase combipres online cheap diovan 160mg cheap
microzide 25 mg usa – hydrochlorothiazide pills bisoprolol 5mg drug
order famvir 500mg – buy valcivir without prescription generic valcivir 1000mg
buy generic digoxin online – order generic lanoxin 250 mg furosemide online
nizoral pills – lotrisone without prescription buy sporanox without a prescription
purchase semaglutide without prescription – order glucovance pill purchase desmopressin online cheap
buy terbinafine 250mg pills – buy fulvicin online buy cheap grifulvin v
prandin pill – empagliflozin without prescription buy empagliflozin 25mg sale
buy glyburide without a prescription – purchase micronase sale buy forxiga paypal
Wow, incredible weblog format! How long have you been blogging for?
you make running a blog look easy. The whole glance of
your site is wonderful, as smartly as the content!
You can see similar here sklep internetowy
desloratadine 5mg tablet – buy flixotide nasal spray for sale albuterol inhaler
stromectol coupon – buy doxycycline online cefaclor 500mg ca
buy generic albuterol – theo-24 Cr 400 mg uk order theo-24 Cr 400 mg sale
azithromycin 500mg sale – buy tinidazole 300mg online cheap ciplox oral
buy augmentin online cheap – trimethoprim sale ciprofloxacin 500mg sale
buy generic amoxicillin for sale – buy cefuroxime 500mg pill buy ciprofloxacin medication
oral clomipramine – order generic imipramine 75mg doxepin 75mg pill
order hydroxyzine online – endep usa amitriptyline cheap
order seroquel 50mg generic – sertraline 50mg drug eskalith sale
buy clozapine cheap – buy quinapril 10 mg online cheap pepcid generic
zidovudine over the counter – avalide buy online buy generic allopurinol
glucophage 1000mg without prescription – cheap lincocin 500 mg order lincocin generic
furosemide ca – buy captopril 25mg pill buy capoten 25mg pills
acillin pills purchase doxycycline generic buy amoxil generic
buy generic metronidazole online – brand azithromycin 500mg order azithromycin 500mg online
ivermectin human – suprax 100mg canada order tetracycline 250mg pills
order valtrex 500mg pill – valtrex price zovirax online order
ciplox brand – erythromycin 250mg pill buy erythromycin 500mg online
order generic flagyl 200mg – metronidazole 400mg pills buy azithromycin without prescription
diyKIqRQZSDar
buy cheap generic ciprofloxacin – buy generic ethambutol over the counter augmentin us
ciprofloxacin drug – buy generic cipro augmentin drug
order lipitor 40mg buy lipitor 20mg without prescription lipitor cost
xlFPwDJBuHNSjgk