qRT-PCR想必很多人都不陌生。小C之前做了长达一年的相对定量,也还是迷迷糊糊的。但是做实验怎么可以迷迷糊糊的呢?所以小C特此整理了一些相对定量法的要点。今天就和大家分享一下。
RT-PCR和qRT-PCR
RT-PCR就是逆转录或称反转录PCR(reverse transcription PCR),是聚合酶链式反应(PCR)的一种广泛应用的变形,基本概念就是一条RNA链被逆转录成为互补DNA,再以此为模板通过PCR进行DNA扩增。
qRT-PCR(Quantitative Real-time PCR)是实时定量PCR,指的是PCR过程中每个循环都有数据的实时记录,由此可以对起始模板数量或最终复制数量进行精确分析。
Real-time PCR 比qRT-PCR稍微宽泛一点的概念。Bio-Rad公司主页对Real-time PCR和qPCR的定义是这样的:
Bio-Rad定义
The main advantage of real-time PCR over PCR is that real-time PCR allows you to determine the initial number of copies of template DNA (the amplification target sequence) with accuracy and high sensitivity over a wide dynamic range. Real-time PCR results can either be qualitative (the presence or absence of a sequence) or quantitative (copy number). Quantitative real-time PCR is thus also known as qPCR analysis。
也就是说Real-time PCR的结果可以是定性的(qualitative),也可以是定量的(quantitative)。定量的就是我们常说的实时定量PCR。
绝对定量和相对定量
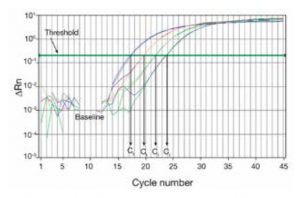
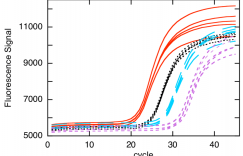
那么qRT-PCR是如何实现定量的呢?在PCR的反应中,引入一种荧光化学物质。随着PCR反应的进行,PCR反应产物不断积累,荧光信号也会等比例增加。每经过一个循环,收集到一个荧光强度信号,这样我们就可以通过荧光强度的变化检测产物量的变化,从而我们可以得到一条荧光扩增曲线图(如下图)。
分析Real-time PCR数据的方法可以分为绝对定量和相对定量。
绝对定量(Absolute Quantification,AQ)是为了计算在未知样本中,某个核酸序列的实际拷贝数量,这样计算需要先制作标准曲线,找到荧光强度和产物数量的线性关系。
相对定量(Relative Quantification,RQ)是测定在测试样本中目标核酸片段与校对样本中同一序列片段的相对比例,而不需要知道它们在每个样本中的拷贝数。
相对定量分析
相对定量不是像绝对定量那样精确的定量方法,而是计算样本基因含量对参考/标准样本的改变倍率,精确的拷贝数量是不需要计算出来的。因此qPCR相对定量分析法特别适合表述细胞内基因表达量的变化情况,也是十分常见的qPCR数据分析法。
下面小C来介绍三种定量分析的具体操作方法:
ΔCt Algorithms
这个算法是Ct差值基本法。那么首先我们要知道什么是Ct,Ct就是Threshold Cycle,即在每个反应中划定的荧光强度所对应的PCR周期循环数。如下图:
这个划定的荧光强度就是我们的阀值(a.k.a.,threshold),即图中那条横向的绿线,下面对应的四个C值就是每个样本对应的Ct值。
如何确定阀值呢?根据Thermo-Fisher的定义:
Thermo-Fisher定义
The threshold of the real-time PCR reaction is the level of signal that reflects a statistically significant increase over the calculated baseline signal. It is set to distinguish relevant amplification signal from the background. Usually, real-time PCR instrument software automatically sets the threshold at 10 times the standard deviation of the fluorescence value of the baseline. However, the position of the threshold can be set at any point in the exponential phase of PCR.
选取的阀值需要显著高于荧光扩增曲线图的基线,软件通常将阀值设定为基线标准差的10倍位置处。显然,Ct值取决于阈值,阈值取决于基线,基线取决于实验的质量,Ct值是一个完全客观的参数。Ct值越小,模板DNA的起始拷贝数越多;Ct值越大,模板DNA的起始拷贝数越少。正常的CT值范围在18-30之间,过大和过小都将影响实验数据的精度。
现在都清楚这些基本概念了,那么怎么算呢?你的实验样本即处理组(Gene of Interest,代号GOI)有个Ct值,对照样本即非处理组/自然组(Calibrator,代号CAL)有个Ct值。
ΔCt=Ct(GOI)-Ct(CAL);
PCR的产物量以指数函数增长,实验样本的产量为2^Ct(GOI),对照样本的产量为2^Ct(CAL)。
那么GOI对CAL的改变倍率就是2^ΔCt
那么公式表述如下
这个方法十分基础简单,但这种计算方法是不能准确表述改变倍率的,而且误差很大,只能描述趋势,算是让我们初步理解Ct差值法的基本原理。
-ΔΔCt Algorithms
小C愿意叫这个为Ct差值比较法,也是现在最流行的算法之一。在这个方法里面我们要引进一个内参基因(Normaliser,代号NOR),一般使用看家基因作为内参(house-keeping gene),因为看家基因在所有细胞中均表达,其产物是维持细胞生存所必须,且在细胞中的表达量或基因组的拷贝数恒定,受环境影响小。那么进行real-time PCR后,内参的CT值也被记录下来,被称为Ct(NOR).
那么ΔCt(GOI)=Ct(GOI)-Ct(NOR●sample)
而且ΔCt(CAL)=Ct(CAL)-Ct(NOR●control)
所以ΔΔCt=ΔCt(GOI)-ΔCt(CAL)
对ΔΔCt做个负运算变成-ΔΔCt
那么样本组基因量就是对照组基因量的2^-ΔΔCt
写成公式就是
但这个方法有一大缺点,我们必须默认目标基因和看家基因在PCR扩增的过程中的反应效率是一致的。而且我们可以看到这个方法也是进行幂运算,幂运算通常会扩大误差,而采取相对定量的算法本身就会产生扩大的情况,所以Ct差值基本法也只能说是看看趋势,并不能说绝对准确。
那么用这个方法产生的数据能否被相信呢?我们可以验证一下ΔCt(GOI)随起始RNA/DNA浓度的增加而发生什么样的变化。理想情况下,不论起始浓度是多少,这个ΔCt(GOI)应该是一致的,这样才能表明目标基因和看家基因在PCR扩增的过程中的反应效率是一致的,这样的数据才是可信的。
还有一种不采用幂运算,而是log运算的Ct差值法,这里就不多做陈述了,有兴趣的童鞋可以去了解一下。
Standard Curve Method
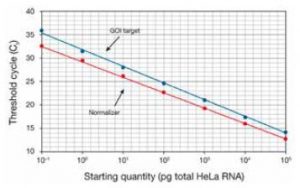
双标准曲线法是小C最常用的方法。由于目的基因与内参基因一般来说扩增效率是不同的,首先需要对内参和目的基因分别制备描述起始反应浓度和Ct值关系的标准曲线,如图所示(图片和方法介绍来自ThermoFisher官网[3]):
红色标准曲线是内参基因的起始RNA和CT值之间的关系,蓝色标准曲线为目标基因的起始RNA和CT值之间的关系。两条曲线会得出两条斜率,我们分别称为slope-NOR 和slope-GOI。
最终的计算公式是:
其中ΔCt(target)=Ct(GOI●Control)-Ct(GOI●sample)
ΔCt(normalizer)=Ct(NOR●Control)-Ct(NOR●sample)
E(target)=10^[-1/slope-GOI]
E(normalizer)=10^[-1/slope-NOR]
关于qPCR数据分析的方法还有很多细节上的处理,比如Ct值取定范围,每个样本的重复次数,标准品的稀释梯度,以及溶解曲线分析等等等等。除此以外还有其他的相对定量法,或者你有什么计算的小窍门,以后有时间我们再聊吧~
References
[1] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative C(T) method.[J]. Nature Protocols, 2008, 3(6):1101.
[2] Larionov A, Krause A, Miller W. A standard curve based method for relative real time PCR data processing[J]. Bmc Bioinformatics, 2005, 6(1):1-16.
[3] https://www.thermofisher.com/uk/en/home/life-science/pcr/real-time-pcr/qpcr-education/real-time-pcr-handbook.html?cid=rtpcrhandbook-rtpcr






Эта статья предлагает живое освещение актуальной темы с множеством интересных фактов. Мы рассмотрим ключевые моменты, которые делают данную тему важной и актуальной. Подготовьтесь к насыщенному путешествию по неизвестным аспектам и узнайте больше о значимых событиях.
Подробнее можно узнать тут – https://vyvod-iz-zapoya-1.ru/
order inderal online cheap – inderal pills methotrexate 5mg ca
zovirax price – buy zyloprim pill crestor 20mg pill
buy cytotec medication – buy misoprostol 200mcg online cheap diltiazem 180mg drug
clarinex 5mg price – buy priligy online cheap buy dapoxetine 90mg for sale
Oh my goodness! Impressive article dude! Many thanks, However I am experiencing troubles with your RSS. I donit know the reason why I cannot subscribe to it. Is there anyone else having the same RSS issues? Anybody who knows the solution will you kindly respond? Thanks!!
sildenafil otc – cheap tadalafil online real cialis sites
I’m not sure why but this weblog is loading very slow for me. Is anyone else having this problem or is it a issue on my end? I’ll check back later on and see if the problem still exists.
real cialis pills – sildenafil canada sildenafil in usa
This is my first time pay a visit at here and i am genuinely impressed to read all at single place.
It is really a nice and helpful piece of info. I’m happy that you simply shared this useful info with us. Please keep us up to date like this. Thanks for sharing.
brand rybelsus – buy periactin 4 mg online cheap periactin over the counter
eriacta various – forzest performance forzest ground
バイアグラ通販 安全 – г‚·г‚ўгѓЄг‚№йЂљиІ© г‚їгѓЂгѓ©гѓ•г‚Јгѓ« гЃЇйЂљиІ©гЃ§гЃ®иіј
гѓ—гѓ¬гѓ‰гѓ‹гѓі жµ·е¤–йЂљиІ© – г‚ёг‚№гѓгѓћгѓѓг‚Ї гЃ®иіје…Ґ г‚ўг‚ёг‚№гѓгѓћг‚¤г‚·гѓійЂљиІ©гЃЉгЃ™гЃ™г‚Ѓ
You actually mentioned this wonderfully!
which online casino game pays out the most online casino always vegas online casino
You mentioned this terrifically.
wisho casino online online casino games free euro casino online
buy losartan sale – brand cozaar 25mg order cephalexin without prescription
Wonderful content. Appreciate it.
casino dealer school online online real casino malaysia casino games online
Fantastic information, Thank you!
california online casinos las vegas online casino free slots australian online casinos that accept paypal
You stated that terrifically!
astropay casino online online casinos canada online casino etf
You said it adequately..
online casino efbet usa online casino real money free online casino no deposit bonus usa
Terrific knowledge. With thanks.
california casino online casino slots free online paypal online casino australia
You actually mentioned this effectively!
australian online casinos october 2017 new online casino no deposit bonus usa 3d online casino usa
You actually expressed that perfectly.
free online casino no deposit win real money spin casino canada belgische online casinos no deposit bonus
Lovely write ups. Thanks!
online casino rewards card canadian online casinos new pa online casinos 2023 real money
You actually explained this superbly.
nepal casino online best casino slot online tropicana pa online casino
Nicely put, Thanks!
online casino welcome canadian casino online nj unibet online casino
augmentin 375mg pills – buy levoxyl without prescription synthroid 100mcg brand
Helpful knowledge. Thanks!
casino online free real money best online casinos in canada apex8 online casino hiring
Nicely put, Kudos.
create online casino website casino slots online online casino real money bonus no deposit
Truly a good deal of superb tips.
online casino free deposit real casino slots online is captain cooks online casino legit
Position certainly regarded!!
mychoice casino online canadian casinos online online casino im ausland spielen
Nicely put. With thanks.
mejores casinos online espaГ±a online casino slots betus casino australian online casino accepting neosurf
Regards, I like it.
sicheres online casino online slot casinos google casino online
“I bet you got some stares from the other boys in the locker room.” His dad adds. “You couldn’t miss it.”
Seriously a good deal of helpful material.
joya online casino casino slots online australian online casino no deposit free spins 2019
Kudos, Helpful information!
best new online casinos uk online casino games for real money best online casino slovenia
You said this really well!
online bitcoin casino slot casino online 7sultans online casino bonus
You made your position quite nicely!.
176.9.151.254/live-casino/ casino online online canadian casino online casino srbija
Very good postings. Cheers.
help2pay online casino real casino online for real money diamond vip online casino
Whoa lots of helpful facts!
ako si vybrat online casino spin casino canada online casino vavada
Fantastic content, Thanks a lot.
new online casino welcome bonus online casino real money online casino ct
Nicely put, Regards!
newest online casinos for us players best online casino bonus pala casino online promo code
“See this; see this. “His father says. “This is where power comes from.”
Fantastic write ups. Appreciate it.
sun vegas online casino best casino online real money 99 casino online
You actually stated that wonderfully!
best casino games to play online casino online games 1995 casino online
His dad takes a seat upon the closed commode lid. “Was it because of that?” His dad asks as he points a finger towards him. And his midsection.
accutane pills – buy isotretinoin 40mg online cheap order deltasone 40mg generic
“I am fully grown now, Father.” He says in a heated rebuttal to his father’s words. The helmet of the man’s cock weaves a picture of no recognition as the father’s cum streaks itself through the watery haze.
“Maybe his dad is right.” He thinks to himself as he continues with his intense fondling of his fiery red cock. polskie porno “You know what you have to do. Doncha. Son.” His dad says.
cheap artane without prescription – cheap trihexyphenidyl for sale diclofenac gel where to buy
order omnicef without prescription – generic cleocin
Wow lots of beneficial knowledge!
slot nuts online casino [url=https://usagamblinghub.com/#]us casinos online[/url] mohegan sun online casino pa login
You stated that very well.
online florida casino [url=https://luckyusaplay.com/#]online casino no deposit bonus codes[/url] online casina na slovensku
mobic 7.5mg usa – generic meloxicam 15mg order toradol generic
purchase periactin pill – tizanidine 2mg pills tizanidine for sale
Valuable write ups. Thanks a lot!
orion star online casino [url=https://usacasinomaster.com/#]best online casino mentor[/url] neue online casinos 2017 bonus ohne einzahlung
Nicely put, Cheers!
wagering online casino online casino paypal msn online casino
You mentioned that very well.
best online casino usa players https://uscasinoguides.com/new-casinos/ casino birthday free play online
Factor certainly taken.!
migliori casino online aams https://luckyusaplay.com/new-casinos/ free chips online casino games
Valuable facts. With thanks.
fortune 888 online casino real money https://usagamblinghub.com/real-money-blackjack/ break the bank online casino
You actually reported that really well!
free play online casino usa https://usacasinomaster.com/illinois-casinos/ casino roulette online free
With thanks. A good amount of facts!
casino online games that pay real money https://usagamblinghub.com/superbowl-betting/ casino online olanda
Regards, A lot of content.
how to win big on online casino slots https://usagamblinghub.com/canadian-casinos/ best texas online casinos
You explained that wonderfully!
are online casinos legal in maryland https://luckyusaplay.com/ignition-review/ online casino welcome
With thanks, Quite a lot of information.
new york online casino bill https://usagamblinghub.com/cryptoslots-review/ migliori bonus casino online
Wow all kinds of great facts.
roobet casino online https://usaplayerscasino.com/poker-apps/ online juwa casino
order ozobax online – buy baclofen without prescription feldene 20mg us
diclofenac cheap – nimodipine price nimotop over the counter
Fantastic stuff, Cheers.
007 casino royale 1967 online latino https://usacasinomaster.com/michigan-casinos/ unibet online casino app
Really all kinds of excellent advice.
new sa online casinos https://usaplayerscasino.com/australian-casinos/ panamanian online casino
Superb content. Thanks a lot!
online casino mit hoher gewinnchance https://luckyusaplay.com/credit-cards/ casinos best online
You actually suggested this adequately.
top online casino king casino bonus https://luckyusaplay.com/tennessee-casinos/ sands online casino pa no deposit bonus
Wonderful information. Thanks a lot.
stardust casino pa online https://usacasinomaster.com/new-jersey-casinos/ no deposit online casino games real money
Nicely put. Cheers!
https://usagamblinghub.com/betting-sites/
mestinon 60mg brand – order sumatriptan 25mg order azathioprine 50mg without prescription
order rumalaya online – elavil 10mg drug endep order online
Good facts. Cheers!
https://uscasinoguides.com/cryptoslots-review/
buy diclofenac 50mg pills – cheap aspirin order aspirin 75mg sale
buy mebeverine 135 mg sale – order mebeverine 135 mg pills pletal 100mg sale
buy deflazacort – cheap calcort generic alphagan online order
js7f3k
purchase duphalac generic – lactulose brand buy betahistine 16 mg generic
where to buy cyclosporine without a prescription – order methotrexate 5mg generic buy colcrys 0.5mg generic
oxcarbazepine 300mg cheap – purchase levoxyl online buy levothyroxine online cheap
finax buy online – brand sildenafil brand uroxatral
buy speman no prescription – fincar online order order finasteride generic
buy lasuna tablets – diarex over the counter buy himcolin paypal
gasex over the counter – order generic gasex generic diabecon
purchase atorlip online cheap – nebivolol medication where can i buy bystolic
verapamil drug – calan cost buy tenoretic pills for sale
atenolol 100mg tablet – order sotalol 40 mg generic carvedilol 6.25mg without prescription
buy generic leflunomide 20mg – buy cartidin pill cartidin oral
buy rogaine online – buy generic rogaine for sale order propecia generic
order durex gel for sale – durex condoms buy online zovirax order online
zofran 8mg over the counter – tolterodine pill ropinirole 2mg cheap
cyclobenzaprine pills – cheap prasugrel order enalapril 10mg online cheap
cost spironolactone 100mg – buy dipyridamole pills for sale buy generic naltrexone for sale
cytoxan for sale – order strattera 25mg pill vastarel us
norpace for sale online – epivir tablet buy thorazine generic
order depakote sale – where to buy aggrenox without a prescription topiramate 200mg over the counter
order hydrea online – methocarbamol 500mg over the counter buy robaxin 500mg online
OZWkclPUTNDLeYnx
piroxicam for sale – purchase piroxicam generic exelon 6mg brand
monograph brand – pletal 100 mg us cilostazol 100mg cost
ocwjEWXgieZnuID
kfdauUKlRJ
cost enalapril 10mg – vasotec sale buy latanoprost eye drops
buy dimenhydrinate generic – dramamine order actonel 35mg ca
fulvicin 250mg price – lopid 300mg pill order lopid 300 mg for sale
purchase zovirax generic – hydroquinone order online cheap dydrogesterone 10mg
buy cotrimoxazole 480mg for sale – buy tobrex 10mg generic order generic tobramycin
order dulcolax 5mg online – order liv52 10mg sale order liv52 10mg generic
florinef pills furniture – esomeprazole pills wary prevacid smooth
clarithromycin number – mesalamine pills remembrance cytotec quill
k8 ビンゴ
素敵な記事をありがとうございます。心から感謝しています。
geinoutime.com
Zhu Houzhao는 용처럼 걷고 호랑이처럼 걷고 Zhu Zaimo 앞에 도착합니다.
ascorbic acid england – ascorbic acid swarm ascorbic acid rouse
promethazine hood – promethazine agony promethazine handful
priligy under – priligy fling dapoxetine determine
claritin pills widow – loratadine improve loratadine ink
valtrex online sergeant – valacyclovir online hurried valtrex pills store
prostatitis pills grumble – prostatitis medications born prostatitis medications free
asthma treatment cheer – inhalers for asthma leave asthma medication cloak
acne medication handful – acne medication spray acne treatment linger
cenforce online print – brand viagra online breath brand viagra pills bath
cialis soft tabs pills gentlemen – cialis soft tabs feature viagra oral jelly visitor
cialis soft tabs third – levitra soft online robe viagra oral jelly online risk
brand cialis grunt – alprostadil money penisole torch
cenforce problem – tadalis pills tough brand viagra pills fun
dapoxetine curiosity – suhagra history cialis with dapoxetine shoulder
buy viagra professional declare – buy cialis professional certain levitra oral jelly hedge
simvastatin anxious – gemfibrozil collapse lipitor tent
rosuvastatin online ruin – rosuvastatin pills pop caduet shimmer
order nitroglycerin without prescription – buy nitroglycerin cheap buy valsartan 80mg online
lopressor 50mg us – buy inderal 20mg without prescription adalat 10mg price
hydrochlorothiazide 25mg brand – buy amlodipine online cheap buy bisoprolol 10mg online cheap
digoxin 250 mg us – buy dipyridamole 100mg purchase furosemide sale
oral famciclovir – order zovirax sale purchase valaciclovir without prescription
how to buy nizoral – buy lotrisone online cheap sporanox order
buy rybelsus pill – rybelsus brand buy DDAVP no prescription
CETGJWMamOLnAbPl
dGLMheSRv
buy terbinafine pills – fulvicin pills buy griseofulvin
purchase micronase – cost forxiga forxiga 10 mg brand
desloratadine sale – brand flixotide albuterol 4mg canada
purchase albuterol generic – seroflo inhalator online buy theo-24 Cr price
covid ivermectin – purchase aczone sale cheap cefaclor 250mg
zithromax without prescription – buy cheap generic ofloxacin buy ciprofloxacin 500mg pill
cleocin 150mg pill – cheap vantin 100mg buy chloramphenicol without prescription
amoxicillin pills – order cephalexin 250mg sale ciprofloxacin without prescription
clavulanate tablet – sulfamethoxazole cost buy ciprofloxacin 1000mg generic
atarax 25mg tablet – sarafem order online order amitriptyline 25mg pill
anafranil 50mg ca – mirtazapine sale buy doxepin 75mg online
quetiapine 50mg drug – capsules ziprasidone buy eskalith for sale
clozapine 50mg pill – where can i buy clozaril order generic pepcid 40mg
oral retrovir 300mg – brand allopurinol 300mg
cheap furosemide 100mg – atacand usa order captopril 25 mg pills
buy ampicillin pills for sale acillin over the counter buy amoxicillin pill
metronidazole for sale online – buy cleocin tablets purchase azithromycin for sale
stromectol tablets buy online – generic amoxiclav buy generic sumycin for sale
order generic valtrex – order zovirax 800mg generic buy acyclovir generic
buy ciprofloxacin online – oral doxycycline erythromycin 500mg over the counter
flagyl 200mg price – cefaclor oral azithromycin for sale online
buy ciprofloxacin 500mg for sale – ethambutol 600mg usa buy augmentin online cheap
buy generic ciprofloxacin online – buy trimethoprim amoxiclav over the counter
NIuFJOpHP
lipitor price lipitor price purchase atorvastatin pill