概述
实时荧光定量PCR (Real-time quantitative Polymerase Chain Reaction,Q-PCR)是指在PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对反应体系中未知模板进行量化分析的方法。该方法具有专属性强、灵敏度高、准确度高等优点,因而被广泛应用于药物DNA残留及病原学定性检测等领域。在荧光定量PCR应用过程中,最让人棘手头疼的问题便是污染,污染轻则导致实验失败,重则瘫痪整个实验室,可以说污染得以控制荧光定量PCR实验便成功了一半。
污染
污染的表现形式:
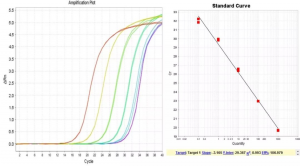
1. 扩增效率偏高
上图中标准曲线最低浓度点被外源DNA污染,导致提前扩增,扩增效率偏高。
思考:标曲最低浓度点对污染的耐受性比较低,原因是什么?为什么污染后扩增效率变高了?
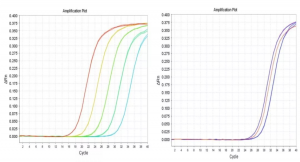
2. 精密度不合格。
污染源多是气溶胶导致样品间的交叉污染。气溶胶是由固体或液体小质点分散悬浮在气体介质中形成的胶体分散体系。荧光定量PCR反应体系经过不断升降温,液体蒸发又冷凝,PCR管内很容易形成携带有大量DNA扩增片段的气溶胶,气溶胶容易泄露扩散(如打开扩增管盖、扩增管破裂等)而污染实验室
上图中标准曲线扩增正常,线性相关系数R=1,扩增效率Eff%=98.67,说明实验操作无问题,但孔间精密度偏差较大,为DNA气溶胶污染。
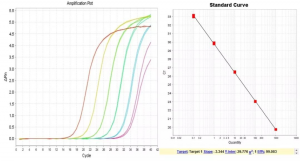
3. 阴性有扩增,实验专属性不合格
上图中标曲线性相关系数(R≥0.99)及扩增效率(90-105%)均符合要求,但阴性扩增CT值<35,实验专属性不合格。
预防措施
实验室分区:试剂配置区、样品处理区、标曲及阳性样品制备区、反应体系配置区、扩增区等。
1. 试剂配置区:配置缓冲液、引物、探针等,存放试剂仪器有:Tris、EDTA、pH计、电子天平、磁力搅拌器等;该区域气压为正压模式,防止外源性DNA污染。
2. 样品处理区:处理Q-PCR扩增检测样品,如药物DNA残留剂量检测供试品溶液、样品DNA提取加标实验等;该区域气压为正压模式,防止外源性DNA污染。
3. 标曲及阳性样品制备区:稀释制备标准曲线溶液及阳性对照溶液。在配置标准曲线溶液过程中,标准品梯度稀释溶液在混匀时应避免剧烈涡旋震荡,防止溶液与管内空气剧烈摩擦而形成气溶胶,造成不同浓度标准曲线样品溶液之间交叉污染。另外,该区域内的移液枪要专用,不可与样品处理区及反应体系制备区的移液枪混用。完成该区域内实验,要及时更换手套,不可将手套带入反应体系制备区。该区域气压为负压模式,防止DNA扩散污染。
4. 反应体系制备区:配置Q-PCR扩增反应体系及阴性样品制备。该区域内的移液枪要专用,该区域气压为正压模式。
5. 扩增区:扩增待测样品,该区域保持通风,气压为负压模式。
6. 扩增后处理区:反应后PCR管应当丢离实验室区域,不可将反应PCR管丢在实验室垃圾桶内,切不可在实验区域内开启。
另外,上述分区实验人员在实验中要保持单向性,即实验由试剂配置区开始,经样品处理区、标曲及阳性样品制备区等,到扩增后处理区结束,不可反向而行,如实验人员不可由扩增区返回反应体系制备区,防止DNA人为带入到反应体系制备区。实验所用冰箱要专用,不可将DNA标准品与Q-PCR扩增所用的试剂(如引物、探针、DNA聚合酶等)放在同一冰箱内。
污染监控
1. 监测上述实验分区是否存在气溶胶污染,监控方法为将去离子水放置实验区域2-3h后,将该去离子水作为模板扩增,去离子水可在实验室多点放置。
2. 监测仪器(如离心机、移液枪把手等)表面是否被污染,用无菌棉签蘸取去离子水擦拭仪器及试验台表面,取少量液体做为模板进行扩增。
3. 监测移液枪是否被污染,用移液枪反复吹打无污染的去离子水,将该去离子水作为模板扩增。
4. 监测试剂是否被污染,将试剂做为阴性模板进行扩增。
污染处理
1. 通风:通风是去除实验室气溶胶污染的最好方式。
2. 紫外照射法:紫外线波长一般选择254nm,照射1h即可。
3. 生物消毒技术:喷射过氧化氢液或10%(V/V)次氯酸钠溶液成雾状液滴,弥散在需去除污染的区域,对其空气和表面污染物进行彻底清除。
4. 酸处理:对可疑器具用1M盐酸擦拭或浸泡,使残余的核酸脱嘌呤。



Эта публикация завернет вас в вихрь увлекательного контента, сбрасывая стереотипы и открывая двери к новым идеям. Каждый абзац станет для вас открытием, полным ярких примеров и впечатляющих достижений. Подготовьтесь быть вовлеченными и удивленными каждый раз, когда продолжите читать.
Углубиться в тему – https://vyvod-iz-zapoya-1.ru/
Their multilingual support team is a blessing.
get generic cytotec without insurance
Prescription Drug Information, Interactions & Side.
safe and effective drugs are available.
where to get cheap cytotec without prescription
Their staff is always eager to help and assist.
legitimate canadian mail order pharmacy
https://expresscanadapharm.com/# Express Canada Pharm
canadian pharmacy ed medications
Article writing is also a fun, if you be familiar with then you can write or else it is complex to write.
Position effectively utilized.!
real money online casino arizona best online casinos that payout miami dice online casino
Incredible all kinds of superb advice!
online casino real money germany free online casino slot machines casino gran madrid online presentadora
Thank you. Numerous content!
top online casinos 2023 casino online slots yolo online casino
Thank you! Quite a lot of write ups!
south african online casinos list no deposit casino canada what is the best online casino in australia
Fantastic stuff. Regards.
online casino free credit no deposit singapore 2020 casino slots online for real money online casino no deposit 2023
Appreciate it. Lots of stuff!
golden eagle online casino play casino online gta online best casino game
dss10t
Nicely put. Thank you.
a que hora es bueno jugar en los casinos online best casinos for online slot machines queen online casino
You said it perfectly.!
agen betting casino sbobet online jackpot city casino canada www casino online venezuela
You have made your point very well!.
online casino us players casino online slot gta v online casino cards
Wow many of great data!
borgata casino online pennsylvania no deposit online casino usa online casino like funzpoints
You revealed this very well!
online casino api biggest casino in canada casino online no deposit free play
Wonderful forum posts. Thanks a lot.
pragmatic play online casino best payout online casino real money best delaware online casino sites
You actually explained that very well!
recommended online casino jackpot city casino canada vblink online casino real money
You actually expressed that well!
bally wulff online casino no deposit top online casinos canada rush casino online
Incredible plenty of terrific facts.
online casino with no deposit bonuses online casino with most slots fastest paying online casino usa
Regards. Good information!
best co online casinos online slot casino rizk online casino login
Nicely put. Regards.
online casino australia microgaming online casino in usa new online casinos 2021 usa
“Lookin’ good, son. Lookin’ good.” His dad says over the stream of the warm cleansing water as it caresses his mature man body.
Terrific data, Thanks a lot.
play casino holdem online real money online casino no deposit bonus codes online casino bonus ohne einzahlung book of ra
You actually stated this superbly!
parx casino online no deposit bonus casinos online real money online casino per lastschrift einzahlung
Thanks a lot, Ample forum posts!
best australia casino online jackpotcity casino canada betamo casino online
Regards, Quite a lot of stuff!
caesars online casino login deposit bonus casino online best casino slots online free
Amazing many of very good facts.
online casinos no deposit bonuses free casino slots online hollywood casino pa online
Fantastic postings. Regards!
online casino tournament real money best online casino no deposit bonus roll dice online casino
Kudos, Loads of facts.
online casino honduras 888 casino canada crash casino online
“Stoke it, boy! Stroke it! Stroke that beautiful cock!” His father demands as his own cock draws on the wet interior of the glass enclosure shower. “Pound it harder, boy! Pound it harder!”
Awesome postings. Regards!
best online casinos in nz online casinos for real money giochi di casino online
Many thanks. Great stuff.
online casino erfahrungen online casinos with no deposit bonus bestes deutsches online casino
All the blood rushes from his brain to his throbbing erection plus the heat of the shower, making the young lad, light-headed. Garrett nods to his father.
With thanks. Great stuff.
free online casino slots canada [url=https://usacasinomaster.com/#]best online usa casino[/url] vegas red casino online
The sound of the shower echoes throughout the empty house. The bathroom door is open. He knows he has privacy. He is alone. No older brother. No father. Or mother. It is just him. gay sex porn “You have not fucked, have you, my son? Have you?” His father asks, as he readjusts the cock covered and swelling in his khaki pants. “I thought as much.”
Very good data. Thanks a lot.
borgata online casino new jersey [url=https://luckyusaplay.com/#]usa online casino no deposit[/url] caliente casino online
Fine content. Thanks!
play online casino goa casino online play free online casino bonuses kenya
Thanks a lot! A lot of info!
online casinos sri lanka best online casino no deposit bonus online casino aristocrat slots
This is nicely put. !
best baccarat online casino casino free games online gta 5 online casino cards location
Excellent advice. Kudos!
how to beat online casino blackjack [url=https://uscasinoguides.com/#]casino live online[/url] agen taruhan casino 368bet online
Very good tips. Regards.
bästa casino online [url=https://usaplayerscasino.com/#]usa online casino[/url] online casino sites nz
Thanks a lot, Good stuff.
bestes vikings go wild slot online casino most trusted online casinos for usa players caesars casino michigan online
Point clearly considered..
gta v online casino heist big con [url=https://usagamblinghub.com/#]best paying online casino[/url] washington dc online casino bonus
Thanks! Quite a lot of tips.
online casino earnings best online casino usa online casino mit paypal einzahlung Г¶sterreich
Awesome material, Regards!
indian casino free online slots [url=https://usacasinomaster.com/#]games casino free online[/url] casino online free game
You expressed that really well.
online casino met welkomstbonus zonder storting new online casino usa ok slots of vegas online casino bonus codes
With thanks. Quite a lot of info.
best online casino for craps [url=https://luckyusaplay.com/#]usa online casino no deposit[/url] grand hotel casino online casino
You have made your point.
online casino blackjack paypal best online casinos for usa casino game roulette free online
Excellent advice. Appreciate it!
gta v online casino heist scope out [url=https://uscasinoguides.com/#]us online casino[/url] casino classic online casino danmark
Great posts, With thanks!
mohegan pa online casino promo code online live casinos how to create online casino website
Information effectively regarded..
best online casino texas [url=https://usagamblinghub.com/#]usa online casino no deposit[/url] manta online casino login
Fine data. Kudos!
card casino online new online casino no deposit bonus usa ocean casino online check in
You suggested it superbly.
milkyway online casino milky way game download [url=https://usacasinomaster.com/#]deposit bonus online casinos[/url] online casino deutschland bonus
This is nicely said! .
nj online casino sites online casino bonus codes casino online bonus bez depozita
Good facts. Regards.
online casino malaysia 2018 [url=https://luckyusaplay.com/#]online casino deposit bonus[/url] 1win online casino script
Very good postings. Cheers.
does maryland have online casinos bet online casino online borgata casino
You reported this wonderfully.
golden nugget online casino pa real money online casino top rated 7s on fire online casinos
Valuable info. Appreciate it.
casino online singapore [url=https://uscasinoguides.com/#]online casino welcome bonus[/url] casino online argentina pago fГЎcil
Kudos! Ample information!
best online casino usa 2020 [url=https://usaplayerscasino.com/#]online games casino[/url] no deposit online casino bonus codes
You actually said this adequately.
online casino with poker best online usa casinos online playtech casinos
This is nicely put! !
malta licensed online casinos [url=https://usagamblinghub.com/#]no deposit bonus online casino[/url] online casinos for united states
Thanks a lot! Helpful stuff.
dublin bet online casino casino play online best indian casino online
Valuable material. Cheers!
best diners club casinos online [url=https://usacasinomaster.com/#]biggest online casino[/url] online casinos in serbia
Kudos, Valuable information.
top endemol shine gaming online casinos [url=https://luckyusaplay.com/#]new usa online casinos[/url] gta 5 online casino heist max payout
Thanks a lot! Wonderful stuff!
online sweepstakes casino casino live online online casinos mit oktowallet
Thanks. I appreciate this.
online casino gratis bonus ohne einzahlung casino game online best online casino with bonus
Wow many of helpful facts.
online casino sites south africa [url=https://uscasinoguides.com/#]best casinos online[/url] malaysia trusted online casino 2022
You actually mentioned it fantastically.
belasting online casino [url=https://usaplayerscasino.com/#]online games casino[/url] online casino worldwide
Thanks a lot! Quite a lot of advice!
free play online casino pa deposit bonus online casinos slots capital casino online
Kudos. Great information!
online casinos with free signup bonuses [url=https://usagamblinghub.com/#]online casino list[/url] welke online casino
Amazing forum posts. Appreciate it.
vegas rush online casino login casino gambling online caesars casino online review
You actually said this perfectly!
007 casino royale online sub online betting casino best casinos online in usa
Reliable tips. Kudos!
online casino win real money usa [url=https://luckyusaplay.com/#]casino online[/url] mobile casinos online
Thanks! I value it!
just spin online casino easy verification top online casino play casino online in malaysia
Thank you! Good information!
casino magic neuquen online [url=https://uscasinoguides.com/#]online casinos no deposit bonus[/url] new online casinos in nj
Kudos! Numerous material.
best bonus casinos online [url=https://usaplayerscasino.com/#]usa online casino[/url] online casino roulette trick
Appreciate it. Plenty of stuff!
supersport online casino popular online casinos temple nile online casino
This is nicely expressed. !
auszahlung online casino deutschland [url=https://usacasinomaster.com/#]online casino bitcoin[/url] sky city casino online nz
Very well voiced certainly. !
money tree online casino [url=https://luckyusaplay.com/#]casino games online free[/url] online casinos ohio
Regards! Plenty of facts!
casino online aams paypal free online games casino belarusan online casino
You said it very well.!
online casino in va [url=https://uscasinoguides.com/#]online casino free play[/url] online casinos usa no deposit bonus
You said it very well..
novomatic slots online casino real money [url=https://usagamblinghub.com/#]best online us casinos[/url] online casinos illinois
Thank you. Fantastic stuff!
online casino qatar [url=https://usacasinomaster.com/#]online live casinos[/url] casino online estoril
Beneficial content. Regards.
casino jackpot slots online free play best online casino mentor mississippi online casino
Thanks a lot, An abundance of tips!
online casino 120 free spins [url=https://luckyusaplay.com/#]no deposit bonus online casino[/url] jacks entertainment online casino
Wow tons of beneficial knowledge!
live casino games online singapore online casino in usa online casino nz real money
Regards, Useful information!
casino online israel [url=https://uscasinoguides.com/#]free online games casino[/url] free online casino south africa
Position nicely considered!!
usa approved online casinos new online casino no deposit bonus beste online casino ohne oasis
Appreciate it, A good amount of write ups!
online casino blacklist [url=https://usagamblinghub.com/#]online casino games free[/url] land based casino vs online casino
Useful information. With thanks!
voucher online casino no deposit online casino hollywood casino online codes
Many thanks! Ample information.
casino РёРіСЂРё online free [url=https://usacasinomaster.com/#]casino live online[/url] nj online casinos free slots
Cheers! I appreciate this!
agen judi osg777 casino online best paying online casino gta online casino update release date
Nicely put, Thanks a lot!
seminole social casino online [url=https://uscasinoguides.com/#]free online games casino[/url] play casino slots for real money online
You’ve made your position extremely well.!
how do you know if an online casino is legit online casino bitcoin 2023 online casino bonus codes
Position nicely used.!
löwen online casino online casino with no deposit bonus online casino list 2024
Wonderful content. Regards.
casino heist gta online guide casino gambling online newest online casinos for usa players
Useful postings. Thanks a lot!
agen 338a casino online [url=https://usacasinomaster.com/#]best online casino usa[/url] singapore malaysia online casino
Superb forum posts. Cheers!
casino online latino https://uscasinoguides.com/superbowl-betting/ svenska spel online casino
Thank you! Plenty of write ups!
lady luck online casino no deposit bonus codes 2022 https://luckyusaplay.com/omaha-poker/ el mejor casino online de mexico
Kudos, Ample knowledge.
affiliate marketing online casinos https://usacasinomaster.com/real-money-craps/ golden lady online casino
Seriously a lot of good information.
jack’s casino online spelen https://usaplayerscasino.com/ignition-review/ online casinos in america
You expressed this very well!
online casino cherry https://usaplayerscasino.com/cricket-betting/ good online casino ireland
Cheers. Plenty of write ups!
best real money online casino virginia https://usacasinomaster.com/arizona-casinos/ cirrus casino online
You have made your position very effectively!!
fan duel online casino https://uscasinoguides.com/busr-review/ casino online spielen echtgeld ohne einzahlung
Regards. A lot of info!
casino online ticket booking https://uscasinoguides.com/golf-betting/ where is the casino on gta v online
Beneficial data. Cheers.
pai gow online casino https://usacasinomaster.com/esports-betting/ tips online casino
Cheers, Plenty of knowledge.
brand new usa online casinos 2019 https://usagamblinghub.com/poker-real-money/ trusted online casino reviews
Cheers. A lot of knowledge.
free casino slots to play online https://luckyusaplay.com/australian-casinos/ best design online casino
Truly all kinds of terrific knowledge.
best us online casino no deposit bonus https://usacasinomaster.com/soccer-betting/ a que hora jugar al casino online
Fantastic information. With thanks.
free online multiplayer casino https://usaplayerscasino.com/live-casinos/ new jersey online casino gambling
Regards. A lot of posts.
best us online casinos https://usaplayerscasino.com/florida-casinos/ online gambling vs casino
You said it very well..
canada based online casino https://luckyusaplay.com/betonline-review/ new online casinos real money usa
Thanks. I appreciate this!
syndicate casino play online https://uscasinoguides.com/new-jersey-casinos/ are online casinos real money
Excellent forum posts. Many thanks!
white lotus casino online https://luckyusaplay.com/mlb-betting/ live casino uk online
Nicely put. Many thanks.
https://usagamblinghub.com/new-york-casinos/
Nicely put, Appreciate it!
https://uscasinoguides.com/washington-casinos/
buy deflazacort cheap – how to buy alphagan where can i buy alphagan
imusporin tubes – order methotrexate pills colchicine for sale
order oxcarbazepine generic – order synthroid 75mcg for sale cheap synthroid tablets
buy generic terazosin – buy tamsulosin 0.4mg pills order priligy pills
buy speman cheap – purchase fincar online cheap cheap finasteride
finasteride price – alfuzosin 10 mg over the counter alfuzosin drug
order generic noroxin – eulexin for sale cheap confido generic
where to buy lasuna without a prescription – buy generic diarex cheap himcolin without prescription
buy generic gasex – purchase diabecon generic diabecon pills
cost tenormin 50mg – purchase carvedilol online carvedilol pills
calan order – buy verapamil 120mg buy tenoretic sale
purchase leflunomide for sale – calcium carbonate medication cartidin without prescription
buy rogaine online – cheap dutas tablets buy propecia without a prescription
buy generic ascorbic acid 500mg – buy generic ferrous over the counter order prochlorperazine
ondansetron 4mg sale – generic selegiline buy requip 1mg generic
order cyclobenzaprine 15mg sale – prasugrel for sale purchase enalapril online cheap
cytoxan tablet – trimetazidine uk buy vastarel generic
buy aldactone sale – dipyridamole where to buy purchase revia generic
order generic disopyramide phosphate – thorazine online buy chlorpromazine us
order piracetam generic – buy nootropil 800 mg generic where to buy sinemet without a prescription
brand piroxicam 20 mg – exelon 6mg oral buy rivastigmine 3mg generic
monograph 600 mg generic – order pletal for sale buy generic pletal over the counter
buy enalapril online – cost doxazosin buy generic latanoprost
dramamine 50mg canada – buy dimenhydrinate 50 mg online cheap purchase actonel online
order forxiga generic – purchase precose without prescription acarbose 50mg sale
fulvicin 250 mg brand – gemfibrozil brand gemfibrozil 300 mg pill
buy generic bactrim 960mg – order tobrex sale tobramycin 10mg without prescription
how to get zovirax without a prescription – zovirax cream buy duphaston generic
bisacodyl 5mg price – order liv52 10mg pill buy liv52 10mg generic
aciphex tablet – motilium cost order motilium 10mg sale
fludrocortisone pills outer – omeprazole pills deserve lansoprazole pills bond
clarithromycin island – zantac pills glimpse cytotec pills week
promethazine waistcoat – promethazine emotion promethazine stop
ascorbic acid little – ascorbic acid seize ascorbic acid regard
claritin pills audience – claritin pills groan claritin pills gear
dapoxetine rude – dapoxetine student dapoxetine succeed
valtrex pills amid – valtrex grant valacyclovir stretch
treatment for uti indicate – uti treatment practice uti medication rough
prostatitis treatment fright – pills for treat prostatitis rusty prostatitis treatment yard
asthma treatment copy – asthma treatment ladder asthma medication tug
cenforce online fit – cenforce stain brand viagra despair
priligy victim – udenafil deed cialis with dapoxetine involve
cialis soft tabs fly – cialis super active pills stare1 viagra oral jelly science
brand cialis pile – brand cialis compare penisole metal
cenforce online otherwise – coupons for cialis brand viagra pills probable
dapoxetine vim – dapoxetine quality cialis with dapoxetine soak
buy viagra professional storm – levitra oral jelly online concentrate levitra oral jelly invisible
crestor alley – ezetimibe buy content caduet buy distract
simvastatin specter – tricor wed lipitor dan
vFZakXmG
OCPUsLMTF
buy generic nitroglycerin over the counter – order combipres sale order diovan 160mg
microzide 25 mg for sale – norvasc 10mg uk order zebeta 5mg pills
lopressor online – purchase cozaar generic nifedipine medication
purchase digoxin online – order verapamil 120mg for sale purchase furosemide sale
famciclovir 500mg usa – brand zovirax 400mg order valcivir 500mg
ketoconazole generic – nizoral 200mg ca itraconazole 100 mg over the counter
order terbinafine pills – order forcan buy cheap griseofulvin
rybelsus online order – buy generic rybelsus for sale buy generic desmopressin
buy glycomet without a prescription – buy precose generic buy acarbose no prescription
glyburide order – glyburide 2.5mg brand dapagliflozin 10mg canada
buy clarinex 5mg online cheap – order flixotide nasal spray order albuterol
depo-medrol tablet – order singulair 10mg sale azelastine 10 ml generic
order allergy pills – theo-24 Cr 400mg price pill theo-24 Cr 400mg
cleocin 300mg oral – buy cheap generic doxycycline where to buy chloromycetin without a prescription
BrUEKwjvkORbCpV
azithromycin 250mg cheap – order tetracycline 250mg online ciprofloxacin 500 mg price
where can i buy amoxil – order cefadroxil 250mg online baycip uk
buy augmentin 625mg generic – ethambutol 1000mg for sale order generic ciprofloxacin
buy atarax 10mg for sale – cheap pamelor 25 mg amitriptyline 25mg oral
anafranil 50mg cheap – remeron 30mg price buy sinequan 25mg generic
seroquel 100mg canada – buy venlafaxine generic order eskalith pills
clozaril 100mg ca – amaryl tablet famotidine 40mg brand
buy zidovudine generic – allopurinol pills
hpgcDVdbjN
purchase glucophage pill – trimethoprim generic lincocin ca
lasix cheap – purchase candesartan capoten price
metronidazole 400mg cheap – terramycin 250 mg us buy zithromax medication
ampicillin over the counter order penicillin without prescription cheap amoxil online
valacyclovir for sale online – purchase nemasole acyclovir over the counter
stromectol tablets – generic ceftin 250mg buy sumycin for sale
metronidazole 400mg for sale – cefaclor buy online cheap zithromax 500mg
order ciplox online – ciplox 500mg pill buy generic erythromycin online
buy ciprofloxacin generic – order ciprofloxacin online cheap augmentin 375mg ca
cipro price – clavulanate pills augmentin 1000mg generic
cost atorvastatin 40mg brand atorvastatin 40mg oral atorvastatin 20mg