在分析蛋白质的结构和功能时,最重要的是如何得到高纯度的蛋白。现今最常用的方法就是亲和标签系统,已经成为重组蛋白检测和纯化中一个不可或缺的工具。不但如此,它还可能对目标蛋白的理化性质产生有利的影响,甚至可以提高重组蛋白的产量。亲和标签有多种不同的分类方法。根据分子量的大小,可分为“小分子短肽标签”和“蛋白质标签”两大类。小编特地为大家撰写了“细说小分子短肽标签”系列文章,希望能够帮助大家从众多蛋白标签中选择适合自己研究课题的。
第一篇文章要介绍的就是目前高通量蛋白纯化使用的最普遍的亲和标签-His-tag。想必大家对这个标签都不陌生。His-tag被广泛应用于各种表达系统中,也用于表达多种重组蛋白上。His-tag一般由5到15个组氨酸(histidine)组成。那么我们就来简单了解一下它的优点吧:
-
在N-端的His-Tag与细菌的转录翻译机制兼容,有利于蛋白表达;
-
可以使用固定化金属离子亲合层析来纯化His-Tag融合蛋白,操作简单便捷;
-
对目的蛋白本身特性影响不大,而不像一些标签那样容易形成二聚体,从而影响蛋白的特性;
-
分子量非常小 a.不会改变目的蛋白自身的可溶性;b.在融合蛋白结晶后对蛋白结构没有影响。
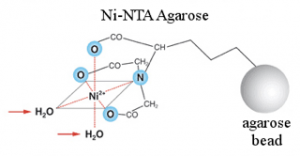
组氨酸的侧链上带有1个咪唑基团 (imidazole group),可以和Ni2+,Zn2+,Co2+等二价过渡金属离子发生特殊的相互作用。这些特殊作用包括配位键结合(coordinate bond),共价键结合 (covalent bond),静电吸附(electrostatic adhesion)等等,其中以配位键结合为主。根据实验发现,咪唑侧链和Ni2+的亲和力相对最为强烈,成了使用最广泛的固定化亲和层析。由此一来,His-tag融合蛋白就可以通过采用固定化金属离子亲和层析进行分离和纯化。这个所谓的固定化金属离子亲和层析(immobilised metal ion affinity chromatography),也被称为金属螯合层析。这些金属离子能够用鳌合配体(chelating ligand)固定在层析介质上。当带有His-tag的融合蛋白经过装有金属离子的亲和层析时,可以选择性的结合在上面;其他杂质蛋白就不会结合或是结合力很微弱。结合在亲和层析上的融合蛋白可以通过提高缓冲液中的咪唑 (imidazole) 的浓度来进行竞争性洗脱 (competitive elution),从而达到蛋白纯化的目的。
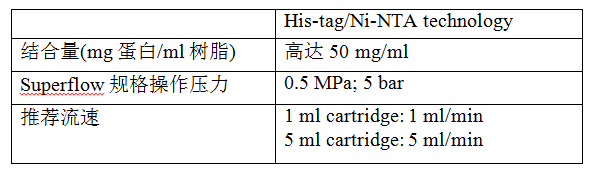
随着这项技术的发展,一些公司开发出了多种不同基架的亲和层析树脂,主要有Ni2+-NTA和Ni2+-IDA。Ni2+-NTA树脂相对比较便宜,结合容量很高,能够进行多次再生循环,并且耐受很强的还原剂,成了现在固定化金属离子亲和层析最主要的层析介质。表格1详细列出了QIAGEN公司Ni2+-NTA技术的详细信息。
表格1:QIAGEN 公司重组蛋白纯化树脂信息
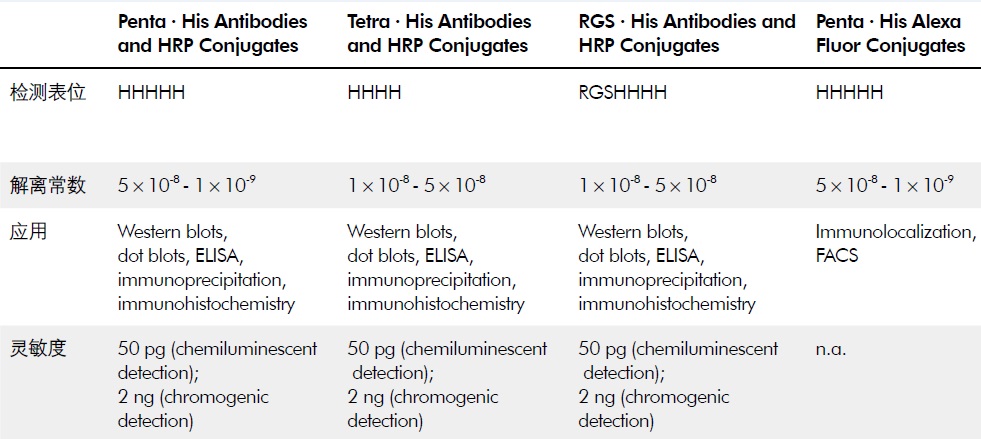
既然已经有了His-tag,那么重组蛋白表达的定性和定量就可以通过Western Blot,ELISA等方法检测。因此小编给大家找到了QIAGEN公司提供的四种不同的His-tag蛋白抗体,供大家参考。
表格2:QIAGEN His-tag蛋白抗体
Reference:
【1】陈爱春, 彭伟, 汪生鹏 “亲和标签在重组蛋白表达与纯化中的应用” 中国生物工程杂志 China Biotechnology, 2012, 32 (12): 93-103.
【2】https://www.qiagen.com/gb/shop/sample-technologies/protein/protein-preparation/ni-nta-agarose/
图片来自网络,内容由BioEngX原创,转载请注明!