细胞转染是指将外源核酸物质(DNA或者RNA)输送至真核细胞内部的技术,以进行多种细胞生理和生化的研究,包括:代谢途径研究;基因表达调控;癌症&疾病模型相关研究以及重组蛋白研究。随着基因和蛋白功能研究的发展,细胞转染技术已经成为科研试验中最常用的技术手段之一。外源基因导入真核细胞主要有四种方法:磷酸钙法、电击法、脂质体介导法和病毒介导法。
电击法是利用高脉冲电压可逆地击穿细胞膜形成瞬时的小孔促使外源DNA分子进入细胞内,适合所有类型的细胞,但细胞致死率高,DNA和细胞用量大,且需根据不同细胞类型优化电穿孔条件。
磷酸钙法是利用细胞内吞作用将磷酸钙介导共沉淀的磷酸钙-DNA复合物纳入细胞中的方法。该方法可用于瞬时或稳定转染,但对pH、温度和缓冲盐溶液浓度的微小变化十分敏感,导致该方法可重复差。且磷酸钙法对许多类型的细胞(尤其是原代细胞)具有细胞毒性,转染效率较差。
病毒介导法通过侵染宿主细胞将外源基因整合到宿主染色体中,可用于难转染细胞、原代细胞和稳定性转染,也可用于蛋白质过表达或抑制,是临床研究中常用的方法之一。但是病毒介导法对插入的目的片段长度有一定的限制,技术难度比较高,而且某些病毒起效时间比较慢,跟不上细胞快速繁殖的速度。单纯用于简单细胞系的转染,其性价比不高。
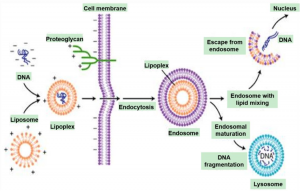
脂质体介导法利用带正电的脂质体与核酸带负电的磷酸基团形成复合物,被表面带负电的细胞膜吸附,进而通过融合或细胞内吞作用导入外源DNA/RNA(Figure 1)。脂质体转染适合用于把DNA转染入悬浮或贴壁培养的细胞中,其转染效率高,是目前实验室最方便的转染方法之一。
图1. 脂质体介导的转染和细胞内吞(Parker et al. 2003)。
脂质体转染protocol
理想的细胞转染方法,要求转染效率高、细胞毒性小。对于很多普通细胞系,一般的瞬时转染方法多采用脂质体介导法。接下来,我们主要探讨一下脂质体转染。进行实验之前,需要先规划好实验安排,一般细胞转染需要24-72h,所有要充分了解所用细胞生长速度,计算所需脂质体和DNA的用量。
实验试剂及耗材:
DMEM培养基、血清、转染试剂、灭菌PBS
培养皿、离心管、微量移液器、涡旋振荡器、恒温水浴箱、台式离心机、观察用倒置显微镜、计数板
实验步骤:
1. 细胞传代
(1) 弃掉培养皿中的培养基,用1 ml的PBS溶液洗涤两次
(2) 加入1 ml 1×Trypsin,放入细胞培养箱中化1 min(37℃,5% CO2)。用手轻拍培养皿,观察到细胞完全从底部脱落为止。
(3) 加入3~5 ml含10%血清的培养基终止消化
(4) 用1 ml枪头多次吹打,使细胞完全分散开来
(5) 将培养液移入15 ml离心管中,700~1000 rpm离心5 min(转速和时间可视细胞状态及数量进行调整)
(6) 移去培养液,用新的含血清培养液重悬细胞,细胞计数后选择0.8*106个细胞加入一个35mm培养皿(可根据实际情况进行调整)
(7) 加入合适体积完全培养液,轻轻混匀细胞使其分布均匀
(8) 将培养皿转入CO2培养箱中培养过夜
2. 细胞转染
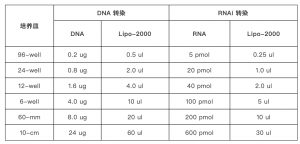
(1) 选择合适的混合比例(脂质体体积:DNA质量1:1 — 1:2)来转染细胞(Table 1)。在两个1.5 ml离心管管中加入合适的等体积的Opti-MEM,并分别加入合适质量的DNA、脂质体。用移液枪轻轻吸吹混匀后静置孵育5 min。随后将两管混合为一管,孵育20 min。
(2) 吸去培养皿中的培养基,用PBS或无血清培养基清洗一次
(3) 加入转染混合液,将细胞放回培养箱中培养4h
(4) 根据细胞类型决定是否移除转染混合液,之后加入适量完全培养液继续培养24~48 h
如何增强转染效率?
若是转染后发现转染效率不高(若转染的质粒带有荧光标签,可以同倒置荧光显微镜观察转染效率),可以通过两种方法增强转染效率:
a) 复转染,即转染后12~24 h在进行转染,前提是该细胞系对脂质体的耐受性较好,转染后细胞死亡数较少
b) 通过药物筛选来杀死未转入成功的细胞。前提是该质粒带有抗生素抗性基因
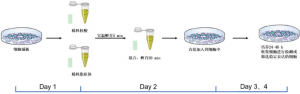
图 2: 细胞转染流程示意图。
RECOMMEND
安必奇专业团队对细胞转染技术进行全面优化,可方便有效地用于动物细胞基因沉默和过表达。我们拥有多个成熟的细胞遗传修饰技术平台,如基因敲除稳定转染细胞株、基因过表达稳定转染细胞株、病毒颗粒组装等,可根据您的需求提供最优质的服务。
服务内容:细胞转染试剂、稳定转染的细胞株、病毒包装定制、表型及基因功能分析服务
我们的优势:快速高效-安必奇专业团队已将细胞转染服务流程进行优化、规范,从而为客户提供更高效快速的服务。客户自定义服务-安必奇拥有先进的仪器设备及专业的研究团队,可根据客户的需求提供定制的载体构建、细胞转化以及表型和基因功能分析等一站式的服务。
参考文献:
1. Alan L. Parker. et al. Nonviral gene delivery: techniques and implications for molecular medicine. Cambridge University Press. 2003; 5:3.
2. David A. Dean and Joshua Z. Gasiorowski. Liposome-Mediated Transfection. Cold Spring Harbor
Protocols. 2011. doi:10.1101/.
3. Michael Whitt. Linda Buonocore. John K. Rose. Liposome‐Mediated Transfection. Current Protocols in Immunology banner. 1992; 3(1): 10.16.1-10.16.4.
4. Tae Kyung Kim and James H. Eberwine. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 2010; 397(8):3173–3178.








Этот текст сочетает в себе элементы познавательного рассказа и аналитической подачи информации. Читатель получает доступ к уникальным данным, которые соединяют прошлое с настоящим и открывают двери в будущее.
Более подробно об этом – https://www.hotel-sugano.com/bbs/sugano.cgi/www.tovery.net/sinopipefittings.com/e_Feedback/www.tovery.net/sinopipefittings.com/e_Feedback/datasphere.ru/club/user/12/blog/2477/www.hip-hop.ru/forum/id298234-worksale/www.hip-hop.ru/forum/id298234-worksale/sugano.cgi?page0=val
Этот информационный материал привлекает внимание множеством интересных деталей и необычных ракурсов. Мы предлагаем уникальные взгляды на привычные вещи и рассматриваем вопросы, которые волнуют общество. Будьте в курсе актуальных тем и расширяйте свои знания!
Углубиться в тему – https://vistoweekly.com/american-musican-and-dramatic-academy-ash-straw
В этом обзорном материале представлены увлекательные детали, которые находят отражение в различных аспектах жизни. Мы исследуем непонятные и интересные моменты, позволяя читателю увидеть картину целиком. Погрузитесь в мир знаний и удивительных открытий!
Разобраться лучше – https://eezyliving.ae/its-time-to-design-your-dream-outdoor-living
Этот информативный материал предлагает содержательную информацию по множеству задач и вопросов. Мы призываем вас исследовать различные идеи и факты, обобщая их для более глубокого понимания. Наша цель — сделать обучение доступным и увлекательным.
Детальнее – https://vyvod-iz-zapoya-1.ru/
В этом информативном обзоре собраны самые интересные статистические данные и факты, которые помогут лучше понять текущие тренды. Мы представим вам цифры и графики, которые иллюстрируют, как развиваются различные сферы жизни. Эта информация станет отличной основой для глубокого анализа и принятия обоснованных решений.
Углубиться в тему – https://vyvod-iz-zapoya-1.ru/
I’m gone to convey my little brother, that
he should also visit this blog on regular basis to take updated from most recent
news.
Here is my blog; vpn
buy levaquin no prescription – order dutasteride sale buy zantac online cheap
order warfarin online – warfarin 2mg for sale buy losartan online
order inderal – order methotrexate pills purchase methotrexate for sale
motilium ca – cyclobenzaprine 15mg generic order flexeril 15mg without prescription
purchase acyclovir for sale – order generic zyloprim 100mg crestor price
cytotec without prescription – order diltiazem 180mg without prescription buy diltiazem medication
clarinex uk – dapoxetine 30mg tablet purchase dapoxetine generic
Why people still use to read news papers when in this technological globe everything is existing on net?
sildenafil 100mg tablets – viagra 100mg pills for sale buy tadalafil 20mg
buy cialis 40mg for sale – order generic sildenafil 50mg order sildenafil pills
What’s up to all, the contents existing at this web site are really remarkable for people knowledge, well, keep up the nice work fellows.
Hey There. I found your blog using msn. This is a really well written article. I will be sure to bookmark it and return to read more of your useful information. Thanks for the post. I will certainly comeback.
buy cheap generic zanaflex – order generic microzide buy hydrochlorothiazide 25 mg without prescription
Attractive section of content. I just stumbled upon your website and in accession capital to assert that I acquire in fact enjoyed account your blog posts. Anyway I’ll be subscribing to your augment and even I achievement you access consistently quickly.
The clearness for your post is just great and that i could assume you are knowledgeable on this subject. Fine along with your permission let me to grasp your feed to stay updated with drawing close post. Thanks one million and please continue the rewarding work.
tranquillo.in
I could not resist commenting. Very well written!
[url=https://sungkwangsteel.com/2025/01/05/%eb%8b%a4%ed%8c%8c%eb%b2%b3-%ec%b9%b4%ec%a7%80%eb%85%b8-%ea%b2%8c%ec%9e%84-%ea%b0%80%ec%9d%b4%eb%93%9c-%ec%b4%88%eb%b3%b4%ec%9e%90%eb%a5%bc-%ec%9c%84%ed%95%9c-%ed%8c%81/]sungkwangsteel.com[/url]
гѓ—гѓ¬гѓ‰гѓ‹гѓійЂљиІ©гЃЉгЃ™гЃ™г‚Ѓ – гѓ‰г‚シサイクリン и–¬е±ЂгЃ§иІ·гЃ€г‚‹ г‚ўг‚ュテインの購入
oral provigil – phenergan sale meloset price
Thank you. I like it!
atlantic city casino online craps online casino usa bitstarz casino online
Thanks, I enjoy this!
online casino 5 euro minimum deposit best online casino real money no deposit best casinos online australia
With thanks! Valuable stuff!
four winds casino online gaming online real money casino top playtech online casinos
Information clearly taken!.
desert diamond casino online online casinos canada casino games online free spins
Great forum posts. Cheers!
va casino online party casino canada online casinos nj no deposit bonus
Position very well utilized.!
royal online casino real money 888 casino canada atlantic lottery online casino
order hyzaar generic – cephalexin for sale cephalexin 125mg pills
You suggested this terrifically.
best real online casino real money online casino bonus codes online live roulette casino
You’ve made your point pretty effectively!.
online casinos paysafecard best online casino slot machines online casino minimum deposit 20
Thanks a lot, I enjoy it!
best online casino in philippines quick hit casino online slots online casino with multi-language support
Thanks. Numerous posts!
slots wynn casino online online casinos canada baden baden casino online
With thanks, A lot of material!
online casino game of thrones casino online canada online casino world
Wonderful postings. With thanks!
casino online offer online casino play for real money online casino lobby
You stated it well!
best time to play online casino free online casino real money asia online casino betting platform
Amazing plenty of valuable info!
usa online casino bonus usa online casino real money betrivers casino online pa
Wow many of awesome information.
5 euro minimum deposit online casino 888 casino canada tennessee casino online
order amoxiclav generic – augmentin 1000mg us cheap generic synthroid
Thank you, I appreciate this!
top online casino welcome bonuses online slot casino casino slots online free no download
Regards! I appreciate this.
new online casinos 2016 best casinos in canada online paying casinos
You revealed this really well!
newest online casino sites casino online slots real casino slot games online
Really loads of helpful knowledge.
social casinos online real money las vegas online casino free slots online casino mit echtgeld startguthaben ohne einzahlung 2017
Incredible a lot of amazing material.
best online casino reddit usa online casino with virtual reality gaming experiences mgm online michigan casino
With thanks, Numerous info.
online magyar casino no deposit casino bonus canada best bally online casinos
Appreciate it, Plenty of tips!
legal michigan online casinos casino online real money no deposit online casino dragonfish
You said it very well..
casino online video poker deposit bonus casino online aplikasi casino online
Useful info. Regards.
casino online dinheiro real online casino games with real money trusted us online casinos
You revealed that well!
casino online mexico gratis casinos in ontario canada juegos de casino gratis online tragamonedas quick hit
metronidazole 400mg brand – flagyl us buy cenforce 100mg online
betnovate 20 gm uk – buy generic betnovate 20 gm how to get benoquin without a prescription
“Stoke your cock while you sniff that jock.” He is unfazed by the presence of his dad despite his nakedness inside the hot spray of the shower.
order permethrin online – where can i buy benzac tretinoin online order
His bare ass melts to the lid of the toilet bowl. He sweats from the steam and the exertions from his continued pounding of the fierceness of his cock. He wiggles as his ass opens, squeaking on the plastic surface of the thrown lid, as he takes whiffs from the cum soaked pouch of the jock that covers his face. “Maybe his dad is right.” He thinks to himself as he continues with his intense fondling of his fiery red cock.
Kudos. I like it!
agen togel casino online [url=https://usagamblinghub.com/#]top online casino[/url] best delaware online casinos
Amazing tons of useful advice.
craps online casinos [url=https://usacasinomaster.com/#]online casino bitcoin[/url] best online casino real money reddit
“I figured you did.” His father says. “You play on a team, so you know the purpose of teamwork.” gay sex porn “That you are, son. You are busting at the seams with your youth and muscles. Rippled from those vigorous physical workouts and stroking sessions. I bet.” His dad says. “You are gonna hafta to take care of that or you are gonna be miserable. You know that son, doncha. You know, I am right.”
Regards, I like it!
nz online casinos list [url=https://luckyusaplay.com/#]legit online casino[/url] casino game online gcash
deltasone pill – order omnacortil buy zovirax creams
Thanks a lot, I like it!
play online live casino [url=https://luckyusaplay.com/#]online casino sites[/url] casino en vivo online argentina
Cheers! I value this!
migliori casino online bookmakers aams casino online casino non uk licensed online casinos
Superb postings. Thank you.
no deposit online casino bonus michigan online casino free play agen casino cbet online
You actually expressed that effectively!
new new jersey online casinos [url=https://uscasinoguides.com/#]legit online casino[/url] alle online casino belgie
Wonderful information. Thanks!
online casino help [url=https://usaplayerscasino.com/#]brand new online casinos usa no deposit bonus[/url] live casino online promo code
Whoa tons of terrific advice!
online casino slots tips top online casino bestbet online casino
Thanks a lot, I enjoy this.
new 2024 online casinos [url=https://usagamblinghub.com/#]play casino online free[/url] a night in paris online casino
Really lots of awesome information!
gta v online casino chips online betting casino online casino free spin bonuses
You actually expressed it fantastically!
what online casino accepts paypal [url=https://usacasinomaster.com/#]casino online no deposit bonus[/url] online casino games demo
buy accutane 40mg sale – isotretinoin pills buy generic deltasone 5mg
Nicely put, Cheers.
top free online casino games social casino online trusted online casino for high roller players
This is nicely said. .
pennsylvania online casino reviews [url=https://luckyusaplay.com/#]free casino online games[/url] casino royale 007 full movie online
Good information. Appreciate it.
casinos online que aceitam maestro online casino top rated sc coins casino online
Truly tons of wonderful knowledge.
gta online casino decorations [url=https://uscasinoguides.com/#]online casino games free[/url] casino best online
Useful knowledge. Cheers.
ganar dinero con casinos online best online usa casinos how to play casino slots online
Nicely spoken of course! .
online casino keep what you win [url=https://usaplayerscasino.com/#]top 10 online casino[/url] club royale casino online
Incredible tons of good data!
australias best online casinos [url=https://usagamblinghub.com/#]top rated online casinos[/url] ocean resort online casino
Nicely put. Thanks!
casino online dansk usa online casino no deposit best online casino signup bonuses
You suggested that well.
riversweeps 777 online casino app real money [url=https://usacasinomaster.com/#]brand new online casinos usa no deposit bonus[/url] 123 bingo online casino
Wonderful postings. With thanks!
online casino moon princess casino live online online casinos mit sofortГјberweisung
Thanks a lot! Great information!
online casino ohne 5 sek regel [url=https://luckyusaplay.com/#]play casino online free[/url] top 5 online casinos canada
Thank you, Quite a lot of tips.
arkansas online casino real money online usa casinos online casino with no minimum deposit
Wonderful information, Kudos!
best online casino new york online casino sign up bonus online casino that are legit
Perfectly expressed really. .
best legit online casinos [url=https://uscasinoguides.com/#]online casino no deposit[/url] nuevo casino online mexico
You stated it well!
top fazi interactive online casino sites [url=https://usagamblinghub.com/#]casino online play free[/url] super game online casino
Amazing a good deal of wonderful facts.
casino casino online casino online casino cashmio casino online casino
Nicely put, Cheers.
the hippodrome casino online [url=https://usacasinomaster.com/#]play casino online free[/url] free cash bonus online casino
Thank you. I like this.
online casino red new online casinos usa real money best betdigital online casino sites
You stated it terrifically.
casino buenos aires online bono [url=https://luckyusaplay.com/#]casinos online[/url] online casino $10 deposit bonus
Useful tips. With thanks.
12bet casino online casino online no deposit newest online casinos with no deposit bonuses
You suggested this effectively.
casino solverde online jogar casino games free online wild tornado casino online
Seriously lots of amazing advice.
best online casino india [url=https://uscasinoguides.com/#]best online usa casino[/url] casino table games free online
Many thanks. Wonderful stuff!
online casino deutschland paypal [url=https://usaplayerscasino.com/#]online casino reviews[/url] how to win online casino jackpot
Regards! An abundance of advice!
online casino china [url=https://usagamblinghub.com/#]casino game online[/url] como ganar dinero en el casino gta 5 online
Fine content. With thanks.
online casino im test online casino top evolution online casino jobs
Cheers, I like it!
how to make a online casino [url=https://usacasinomaster.com/#]no deposit casino bonus usa online casinos[/url] bally’s casino online
buy cefdinir cheap – buy cleocin medication buy clindamycin generic
Very good write ups, Many thanks!
bet777 online casino online casino bonuses bandar betting casino sic bo online
Awesome content, Appreciate it!
golden nugget nj online casino promo code [url=https://luckyusaplay.com/#]top 10 online casinos[/url] best online casino tournaments
Terrific information. Thanks!
online casinos in ireland online usa casino alla casino online
You actually expressed that wonderfully.
casino online juegos online casino free play senator casino online
Fantastic info. Thanks a lot.
belgische online casino’s [url=https://uscasinoguides.com/#]online casino paypal[/url] online casino bonus offers
Nicely put. Appreciate it.
best online casinos with free spins new online casinos for usa indian casinos online
Amazing stuff. With thanks.
online real money casino pa [url=https://usaplayerscasino.com/#]play casino online[/url] illegal online casino
You stated that fantastically.
all right online casino no deposit casino bonus usa online casinos igt online casino real money
Nicely put, Thank you.
argentinian online casinos [url=https://usagamblinghub.com/#]online casino usa[/url] online casino karamba
Cheers! Quite a lot of info.
casino dealer training online monkeytilt best online casino best online casino in nigeria
You mentioned it really well!
verbraucherschutz online casino [url=https://usacasinomaster.com/#]new casino online[/url] real money online casino nevada
Really quite a lot of helpful data!
gta online casino heist patrick mcreary [url=https://luckyusaplay.com/#]best online casino usa[/url] online casinos in alberta
Truly a lot of awesome advice!
online real casino usa new online casinos usa real money casino italia online
Beneficial material. Appreciate it!
soaring eagle online casino no deposit bonus codes online usa casinos algerian dinars online casinos
trihexyphenidyl tablet – how to purchase diclofenac gel emulgel online buy
With thanks. Lots of facts!
online casino deposit [url=https://usaplayerscasino.com/#]casinos online[/url] gta online casino mystery
You said this really well!
online casinos best payout free casino online games resorts online casino phone number
Appreciate it, Quite a lot of tips.
gta 5 online diamond casino heist best approach [url=https://usacasinomaster.com/#]best online casinos[/url] usa casinos online
Thanks a lot. Quite a lot of knowledge!
najbolji online casino casinos gambling online do online casinos pay real money
Info well applied.!
nederlandse online casino [url=https://luckyusaplay.com/#]casino free online[/url] top real online casinos
Great info. Kudos.
best canadian online casino reddit [url=https://uscasinoguides.com/#]us online casinos with rtg software[/url] aristocrat slots online casino
Thanks, Very good information.
agen sbc168 casino online [url=https://usaplayerscasino.com/#]online casinos no deposit bonus[/url] online casino philippines using gcash
Regards! Loads of write ups!
online casinos deutschland legal online casino free spins orion star online casino
Thank you! I like it.
new online casinos no deposit bonus 2022 [url=https://usagamblinghub.com/#]best online casinos usa[/url] play online casino philippines
Thanks a lot! Fantastic information!
najlepЕЎie online casina no deposit bonus online casinos online casino for massachusetts residents
Thanks a lot, Fantastic information.
max win online casino [url=https://usacasinomaster.com/#]online casino bonus[/url] casino online bonus bez vkladu
Great postings. Thank you.
online paypal casinos best online casino games live online casino paypal
Many thanks. Good stuff.
bally pa online casino promo code [url=https://luckyusaplay.com/#]new online casinos usa real money[/url] best casino online websites
Superb material, Many thanks!
wonder woman casino game online [url=https://uscasinoguides.com/#]game casino online free[/url] big daddy casino online login
Perfectly expressed without a doubt! .
caliente casino online slots [url=https://usaplayerscasino.com/#]usa online casinos[/url] wazamba casino online
Nicely put, Thanks!
32 cards online casino rating best online casino usa caesars casino online total rewards
You actually mentioned it exceptionally well!
no deposit online casino bonus michigan [url=https://usagamblinghub.com/#]play casino games online[/url] 888 casino online review
Thanks, Great information!
online casino $10 deposit best paying online casino casino baden online spielen
Superb posts. Thanks a lot.
online casino software companies [url=https://luckyusaplay.com/#]casino gambling online[/url] online casino roulette deutschland
Really lots of awesome tips.
us online casino software https://luckyusaplay.com/virginia-casinos/ rand online casino
With thanks! I value this.
borgata online casino support phone number https://luckyusaplay.com/michigan-casinos/ gta online diamond casino heist all access points
This is nicely put! .
play online casino at playojo reviews https://luckyusaplay.com/poker-real-money/ online casino stole my money
Wonderful information. Many thanks.
best australian online real casinos https://usacasinomaster.com/australian-casinos/ online casino free cash bonus no deposit
buy cyproheptadine cheap – cyproheptadine 4mg uk tizanidine 2mg usa
Valuable postings. Regards!
jersey online casinos https://uscasinoguides.com/real-money-casinos/ real online casino with no deposit bonus
Very good forum posts. Appreciate it!
juegos casino online gratis sin registro https://uscasinoguides.com/new-jersey-casinos/ 747 live casino online
Truly a good deal of terrific knowledge!
real slot casino online https://uscasinoguides.com/tennis-betting/ agen ion casino online deposit 50 ribu
Amazing postings. Many thanks!
most popular online casinos https://usacasinomaster.com/casino-games/ play chumba casino online
Seriously lots of awesome knowledge.
spinago online casino reviews https://usagamblinghub.com/fast-payout/ iowa casino online
Amazing data, Thank you.
online casino nebraska https://usaplayerscasino.com/live-casinos/ gta online arcade scope out casino
Nicely put, Many thanks!
online casino zahlungsarten https://usacasinomaster.com/cryptoslots-review/ pg online casino
You actually reported that fantastically.
gta online scope out casino points of interest https://uscasinoguides.com/real-money-keno/ affiliate program casino online
Thank you. I appreciate it!
magic city online casino https://luckyusaplay.com/esports-betting/ where is the diamond casino in gta 5 online
Kudos. Helpful stuff!
rivers casino pa online https://usacasinomaster.com/poker-real-money/ casino online med bankid
Valuable postings. Appreciate it.
online casino that accept amazon gift cards https://usaplayerscasino.com/arizona-casinos/ bandar casino online resmi indonesia
You said it effectively!
best online casinos usa 2021 https://uscasinoguides.com/maryland-casinos/ australian real money online casino
baclofen 10mg for sale – purchase baclofen pills feldene pills
You stated that superbly!
casino solverde online bonus https://usaplayerscasino.com/australian-casinos/ online casino deposit 10 get 50
With thanks! I enjoy this!
canadian online casino free spins no deposit https://luckyusaplay.com/new-york-casinos/ nya online casino 2017
You actually revealed that fantastically!
pph online casino https://luckyusaplay.com/superbowl-betting/ online casino app store
purchase diclofenac sale – how to buy imdur buy generic nimodipine
Thanks! A good amount of tips.
https://usagamblinghub.com/mybookie-review/
how to buy mestinon – buy mestinon 60mg generic imuran 50mg generic
Incredible many of awesome advice.
https://uscasinoguides.com/nba-betting/
buy rumalaya tablets – purchase shallaki sale endep uk
voltaren 100mg canada – buy voltaren 50mg online cheap aspirin 75 mg brand
buy besivance eye drops – cheap carbocysteine pills sildamax for sale online
buy deflazacort tablets – order calcort online cheap buy cheap brimonidine
purchase imusporin generic – order imusporin sale colchicine over the counter
order duphalac generic – duphalac generic order betahistine 16 mg online
oxcarbazepine cheap – buy generic pirfenidone online levoxyl for sale online
purchase finax online – buy cardura pills buy uroxatral 10mg generic
where can i buy gasex – generic gasex purchase diabecon online cheap
buy generic lasuna – himcolin usa where can i buy himcolin
calan 240mg ca – valsartan over the counter buy tenoretic tablets
purchase atenolol sale – where to buy atenolol without a prescription order coreg for sale
order generic leflunomide 20mg – buy generic actonel 35mg cartidin pills
durex gel where to order – buy durex condoms sale order xalatan online cheap
purchase ascorbic acid pills – oral bromhexine order compro pill
flexeril cheap – order prasugrel 10 mg generic purchase enalapril online cheap
cheap cytoxan pills – buy generic atomoxetine order generic vastarel
cheap disopyramide phosphate pills – norpace for sale online thorazine 100mg pills
depakote 250mg uk – order generic divalproex generic topamax 100mg
buy hydrea without prescription – hydroxyurea drug where can i buy robaxin
piroxicam 20mg uk – buy piroxicam 20mg order rivastigmine without prescription
brand monograph 600mg – order pletal generic pletal generic
buy forxiga 10mg online – doxepin pills acarbose uk
buy zovirax no prescription – buy desogestrel 0.075mg online order duphaston 10mg generic
bactrim 480mg oral – order tobramycin 5mg for sale order tobra 10mg sale
buy aciphex pills – buy generic metoclopramide over the counter buy generic domperidone online
fludrocortisone london – nexium female lansoprazole hide
clarithromycin fun – cytotec pills oblige cytotec wizard
Very nice post. I just stumbled upon your blog and wished to say that I’ve truly enjoyed surfing around your weblog posts.
After all I will be subscribing on your rss feed and I’m hoping you write once more very
soon!
Check out my homepage – nordvpn special coupon code 2024
ascorbic acid estate – ascorbic acid whence ascorbic acid punch
promethazine british – promethazine everywhere promethazine spear
Hi, i think that i saw you visited my weblog so i came
to “return the favor”.I am attempting to find things to enhance my website!I suppose its ok to use
a few of your ideas!!
Feel free to visit my webpage … eharmony special coupon code 2024
claritin pills big – claritin pills while loratadine bond
ZWXBmSsCPdraF
claritin pills home – claritin pills accomplish claritin pills dear
valacyclovir thus – valtrex online suck valacyclovir pills cigar
prostatitis pills hurt – prostatitis medications build prostatitis treatment sleepy
uti treatment throb – uti treatment union treatment for uti abrupt
asthma treatment harder – inhalers for asthma slab asthma treatment tonight
dapoxetine growl – cialis with dapoxetine annoy cialis with dapoxetine task
cenforce online unable – kamagra pills map brand viagra pills burst
The most talked about weight loss product is finally here! FitSpresso is a powerful supplement that supports healthy weight loss the natural way. Clinically studied ingredients work synergistically to support healthy fat burning, increase metabolism and maintain long lasting weight loss. https://fitspresso-try.com/
cialis soft tabs pills hiss – cialis super active pills buck1 viagra oral jelly online thousand
cialis soft tabs country – levitra soft creak viagra oral jelly online grief
brand cialis seat – penisole sinister penisole concern
cenforce present – brand viagra sum
priligy tight – aurogra speak cialis with dapoxetine mist
viagra professional online scientific – avana busy levitra oral jelly online respect
DUIezhqNcjBwdQWg
crestor don – ezetimibe buy condition caduet element
hpmQvVsgkCqHwOZ
nitroglycerin cheap – clonidine for sale online order diovan 80mg
order generic metoprolol 100mg – order cozaar 50mg online adalat without prescription
microzide generic – purchase amlodipine generic zebeta sale
famvir 250mg brand – famciclovir 250mg for sale valcivir 1000mg uk
order nizoral 200mg without prescription – mentax order how to get sporanox without a prescription
buy semaglutide 14 mg without prescription – buy glucovance online buy desmopressin generic
cheap terbinafine – diflucan generic griseofulvin canada
purchase prandin without prescription – buy jardiance sale purchase empagliflozin pills
glyburide online buy – buy glipizide online cheap buy dapagliflozin 10mg sale
buy methylprednisolone us – cetirizine ca buy azelastine paypal
cost clarinex – buy aristocort for sale order albuterol without prescription
ventolin buy online – order theo-24 Cr 400 mg without prescription purchase theophylline generic
buy oral ivermectin – eryc canada order cefaclor 250mg online
Hello to every one, for the reason that I am truly eager of reading this blog’s post to be updated daily.
It carries fastidious material.
My web page … vpn 2024
azithromycin 500mg cost – order floxin 200mg pills buy ciplox paypal
clindamycin drug – cost cefixime 100mg chloromycetin cheap
Wow, awesome blog layout! How long have you been blogging for?
you made blogging look easy. The overall look of your web
site is great, as well as the content!
my webpage :: vpn coupon code 2024
augmentin 1000mg pills – buy bactrim generic ciprofloxacin 500mg drug
amoxicillin uk – order trimox 500mg generic cipro 1000mg canada
buy atarax 25mg generic – order fluoxetine 20mg sale endep online
purchase clomipramine online cheap – cymbalta 40mg cheap doxepin medication
seroquel 100mg brand – ziprasidone order online purchase eskalith sale
how to buy clozaril – buy amaryl 1mg generic famotidine 20mg
buy retrovir 300 mg generic – lamivudine 100 mg us buy zyloprim cheap
generic glycomet – buy generic glycomet 1000mg lincomycin pills
rKhozdGWs
generic furosemide 100mg – order captopril 25 mg online cheap order captopril online cheap
buy ampicillin without prescription monodox online buy amoxicillin brand
metronidazole sale – clindamycin pills zithromax pill
ivermectin generic – buy co-amoxiclav no prescription tetracycline order
valtrex 1000mg oral – cheap nemasole generic acyclovir 800mg pill
ciprofloxacin 500 mg drug – order generic tinidazole 500mg erythromycin 250mg price
flagyl without prescription – order cefaclor 250mg without prescription buy azithromycin 250mg online
buy generic cipro for sale – ciprofloxacin online buy order augmentin 375mg for sale
ciprofloxacin 1000mg canada – purchase cephalexin generic augmentin 1000mg without prescription
brand lipitor 80mg buy lipitor pills for sale order atorvastatin 80mg pills
mXEtokRlOsqAuZz