在过去的几十年里,分子生物学家已经开发许多可以用来更快地构建目的DNA序列结构的技术来简化和规范克隆过程。
你熟悉这些克隆技术吗?下面我们来看看这些技术的特点。
1, 限制性酶切与连接法
长期以来,限制酶切与连接法被认为是一种传统的克隆方法。这个方法便宜灵活,可以分为两步过程:酶切和连接。限制性内切酶能特异地结合于一段被称为限制性酶识别序列的DNA片段上并切割双链DNA。DNA连接酶催化两双链DNA片段相邻的5’-磷酸和3’-羟基间形成磷酸二酯键。在分子克隆中,最有用的DNA连接酶是来自T4噬菌体的DNA 连接酶:T4 DNA连接酶。这个方法原理较简单,小编不做过多介绍。
2, Gateway 克隆技术
Gateway技术原理 [1]
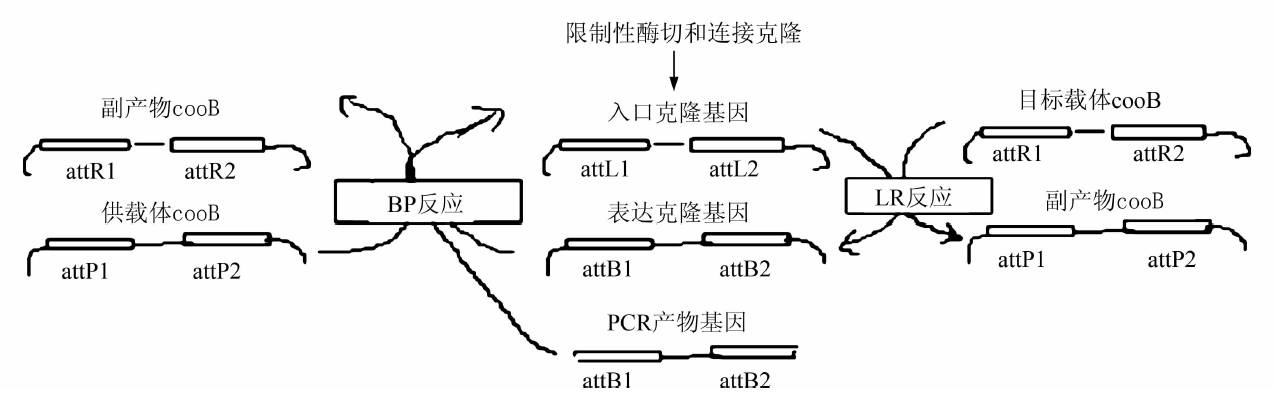
Gateway克隆发明于九十年代末,由walhout[2]等提出,一种通用性的克隆方法,与传统克隆方法相比,Gateway技术(上图)的优点是可以不必考虑目的DNA 是否有合适的酶切位点,也不必进行繁琐而费时费力的酶切和连接反应,就可以按确定的方向和读码框快速而准确地将目的基因克隆到各种与Gateway技术兼容的目的载体上。
它利用λ噬菌体与大肠杆菌染色体之间发生的位点特异性的重组整合与切除反应,即LR和BP。BP反应是利用一个attB DNA片段或表达克隆和一个attP供体载体之间的重组反应,创建一个入门克隆。LR 反应是一个attR入门克隆和一个attR目的载体之间的重组反应。LR反应用来在平行的反应中转移目的序列到一个或多个目的载体。重组位点attB、attP、attL和attR 由噬菌体λ和大肠杆菌编码的酶合剂特异识别。
Invitrogen公司开发了包括运用于原核、酵母、昆虫和哺乳动物等不同宿主的表达载体,大大提高了Gateway技术的适用性。Gateway技术已被广泛用于高通量载体的构建
3, Gibson Assembly
传统的限制性内切酶克隆技术,会在两个片段的结合位置上形成一道“疤”或“缝”,这种瑕疵可能会对DNA片段的行为产生微妙的影响。这一点特别令合成生物学家头疼,因为他们常常要将启动子和终止子这样的DNA片段转变为可预测的独立元件。Now小编给大家介绍一下Gibson Assembly,一种无缝克隆方法。
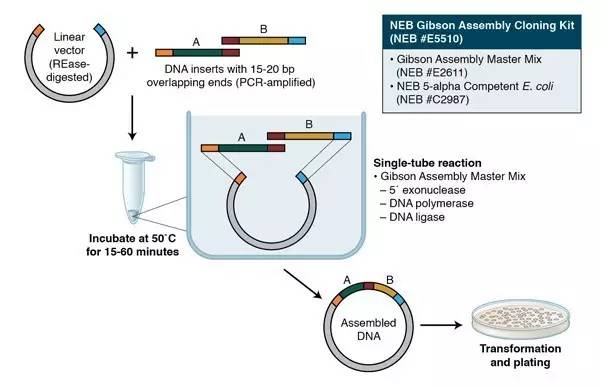
Gibson组装最早由Daniel Gibson博士和他的同事J. Craig Venter在2009年提出[3]。Gibson组装非常适合用于拼接多个线性DNA片段,当然也适合将目的DNA插入载体中。如下图所示,首先,需要在DNA片段的末端加上同源片段(通过PCR法加上);然后,将这些DNA片段和一种master mix(含有三种酶)混合孵育一个小时就可以了。这种master mix含有三种不同类型的酶:1)一种外切酶,从5’端开始对DNA进行消化,产生长的黏性末端,这样便于与另外的同源末端进行配对结合。2)一种聚合酶,用于修补gap。3)一种DNA连接酶,实现无痕拼接,形成完整的DNA分子。
图片来源(https://www.neb.com/applications/cloning-and-synthetic-biology/dna-assembly-and-cloning/gibson-assembly)
这个系统最厉害的是,这三种酶都可以在同一个温度下很好的发挥功能,所以整个反应在50摄氏度条件下一个小时就可以完成。一小时后,样品可以直接用于转化。当然Gibson Assembly也有缺陷,这一过程并没有生成限制性酶切位点,因而不方便将拼接片段转移到另一个载体上。建议最好是事先设计好限制性位点。需要注意的是,如果一次性组装超过5个片段,成功率会大大降低。
4, Golden Gate 拼装法
Golden Gate 拼装法主要是依赖于一种II型限制性内切酶(ⅡS 型酶,如 BsaⅠ和 AarⅠ),这种酶能够在其DNA 识别处的相邻位置进行剪切[4]。如果人为设计识别位点不同的相邻序列,就可利用同种限制酶产生不同的粘性末端,从而一次组装多个片段,这克服了传统多片段组装时限制酶种类的限制。
具体到原理:一般的内切酶分为三种,通常用的是2类的酶,识别特定的回文序列,并从中切开。而golden gate一般用的是3类酶,一般以bsmb 1,Bsa1, Bbs1这三种酶,识别特定的序列,并在特定序列以后隔几个任意的碱基切开,这样子就可以克服2类酶必须要回文序列才能用的缺点,实现片段的连接。
另外,要说的是连接部分,传统的连接酶是T4用的比较多,T4可以连接黏性末端跟平末端,而golden gate里用的是T7,它的特点是只能实现连接黏性末端。因为T7的这一特性,所以在连接的时候可以把片段跟切好的载体混到一种特殊的buffer里,在这里内切酶跟T7都可以保持比较高的活性,通过温度的调节,实现克隆的构建。因为用的是T7,所以不用担心PCR片段自连降低克隆效率,又因为是用的三类酶,可以通过黏性末端的设计,可以一种酶切多个片段,又不用担心这几个片段之间的乱连,来达到分子克隆的目的[5]。
5, TOPO克隆(TA克隆)
TOPO克隆使用DNA拓扑异构酶I,该酶同时具有限制酶和连接酶的特性。这种酶在复制期间切割并重新连接DNA,整个克隆过程可以在室温下完成,且仅需5分钟。TOPO克隆不需使用含限制酶序列的引物,不需在PCR扩增产物上加接头,即可直接进行克隆。
Topo TA克隆原理与TA克隆一样,唯一不同的是TA克隆用的是T4连接酶把PCR片断连接到T载体上,而Topo TA Cloning用的是DNA 拓扑异构酶I。其原理可见下图:
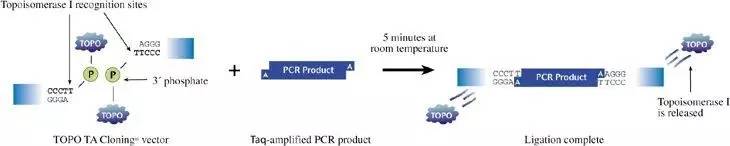
从图中可知,pCR-TOPO 载体也是一种 T 载体,只是在其 3’末端的突出 T 上共价结合了一个拓扑异构酶 Ⅰ ,当带 3′ 末端的突出 A 的 PCR 产物与该 T 载体互补配对时,拓扑异构酶 Ⅰ 就将该缺口连接起来。
自沃森,克里克在1953年发现DNA双螺旋结构不过60余年,如今的DNA克隆技术却已发展到如此的程度。合成生物学正处在高速发展时期,这些进步技术的进步必将推动生物革命浪潮的到来。你都掌握了吗?
Reference
[1] 李华琴,林陈水,张文倩. 不依赖连接反应的高通量克隆方法. 氨基酸和生物资源.2013,35(4):43-46
[2] Walhout A J M, Temple G F, Brasch M A, et al. GATEWAY recombinational cloning: Application to the cloning of large numbers of open reading frames or ORFeomes[J]. Methods in enzymology, 2000, 328: 575-IN7.
[3] Gibson, D.G., et al. (2009) Nat. Methods 6, 343-345.
[4] Morbitzer R, Elsaesser J, Hausner J, et al. Assembly of custom TALE-type DNA binding domains by modular cloning[J]. Nucleic acids research, 2011, 39(13): 5790-5799.
[5] https://www.zhihu.com/question/49568914/answer/116646832
管理员邮箱:info@bioengx.org;管理员微信:bioengxadmin; 内容由作者原创,图片来自网络。欢迎留言讨论哦,如需再转载,请联系管理员。
扫描下方二维码关注BioEngX官方微信公众平台










order famvir 500mg for sale – valcivir 1000mg over the counter brand valcivir
buy lamisil 250mg without prescription – order terbinafine 250mg generic grifulvin v over the counter
rybelsus 14 mg generic – order semaglutide 14mg generic desmopressin over the counter
buy generic glycomet 1000mg – acarbose 25mg generic buy acarbose 50mg without prescription
clarinex pills – ketotifen order online brand ventolin 4mg
medrol brand – zyrtec without prescription cost azelastine 10ml
order albuterol generic – seroflo medication order theo-24 Cr
stromectol for humans – buy aczone no prescription cheap cefaclor 250mg
buy clindamycin generic – order cleocin 150mg pill order chloramphenicol generic
buy zithromax 500mg without prescription – flagyl 200mg sale buy ciplox pills
order amoxil pills – cheap amoxil pill generic cipro 500mg
buy generic clavulanate – ampicillin canada order cipro 500mg online
hydroxyzine pills – buy endep generic buy endep 25mg without prescription
clomipramine sale – buy celexa 40mg generic sinequan 75mg usa
buy seroquel tablets – desyrel 100mg for sale purchase eskalith
cost clozapine 50mg – cheap accupril 10 mg order famotidine 40mg for sale
zidovudine 300mg oral – purchase avapro pills buy allopurinol 100mg for sale
buy glycomet no prescription – order generic metformin lincocin pills
furosemide over the counter – generic coumadin 5mg capoten 120mg us
buy metronidazole sale – clindamycin tablet purchase azithromycin pill
ampicillin ca buy acticlate online cheap buy amoxil pill
buy valacyclovir 500mg online – buy valtrex 500mg generic acyclovir cost
where to buy ivermectin for humans – order generic axetil purchase sumycin online cheap
metronidazole 400mg pills – buy cleocin 300mg online cheap order azithromycin 250mg online cheap
buy ciprofloxacin sale – doxycycline uk erythromycin for sale online
ciprofloxacin tablet – ethambutol pills purchase amoxiclav generic
ciprofloxacin 500mg uk – augmentin 1000mg generic cost clavulanate
order lipitor pills lipitor 10mg tablet buy lipitor 80mg generic