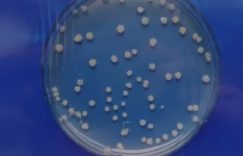
Western Blot的过程复杂繁琐,大家难免会在实验中遇到一些问题。而且整个实验耗时较长,所以我们要尽可能的利用现有的转渍膜和蛋白样品。如此一来,剥离和再探测的技术也就应运而生。
有科学依据的原因:
-
蛋白质样品或是昂贵或是有限的
-
用相同的或是不同的抗体来重新确认实验结果;
-
蛋白样品可以使用不同的抗体来分析,这样在比较相对含量的时候非常有用。例如,可以测量磷酸化的蛋白质在总蛋白中的含量。
在实验室中更“接地气”的原因:
-
去除用错了的抗体(不要不相信,真的有小伙伴加错过)或是使用了不合适的抗体浓度;
-
省去重新跑胶和转渍的时间;
-
去除掉不合适的封闭液,重新来过。
了解了原因之后,大家是不是觉得多多少少都想尝试着在Western Blot之后进行一下剥离再探测呢。那么现在,小编就给大家讲讲三种不同的剥离技术。每种技术的目的都是尽可能的去除掉结合的抗体并且尽最大可能保证转渍膜上蛋白质样品的数量和质量。
方法一:低pH值甘氨酸溶液
这种方法通常被称为“温和剥离法”。这种方法操作起来很简单,使用低pH值的甘氨酸溶液让结合的抗体离解。低pH值之所以能离解结合的抗体,是因为它可以使抗体-抗原的结合位点失活。这种溶液的配方是将固体的甘氨酸溶进水中,并且用浓酸把pH 调整到2.2。通常情况下还要加入0.1–1% SDS (w/v) 来增加蛋白质的离解。转渍膜在抗体剥离缓冲液里的培养时间是30-60分钟。值得注意的是,如果大家要二次利用抗体,千万不要在缓冲液里加SDS。SDS可以使蛋白质失活,抗体也不例外啦!而且要记得重新调整pH再使用回收的抗体,否则抗体很可能还没有回复原本的结构!
方法二:加热和洗涤
这个方法就没有那么温和了,但是对信号强的Western Blot很适合。这种方法可以改变抗体的二次结构,使其脱离原本结合的抗原(蛋白质样品)。在使用前,通常在中性的Tris-HCl溶液加入还原剂,例如2-巯基乙醇和SDS。在转渍膜中加入适量的调制好的缓冲液,再将缓冲液加热到50-80度,持续45分钟即可。值得注意的是,这个方法加入了还原剂,所以回收之后的抗体已经失活并且是活性是不可逆的,就不能再次使用了。与此同时,清洗转渍膜一定要彻底,否则新加的抗体也可能在残余的还原剂中失活。
方法三:商品化抗体剥离缓冲液
这些抗体剥离缓冲液都是有专利的,所以我们对其中的配方不得而知。但是商家的介绍大都表示比以上两种方法更温和。因为不需要加入硫醇,更不需要高温。神奇的是,在需要的时间比实验室里的自制办法要短的情况下(有的只需要15分钟),剥离效率几乎没有被影响。小编在这里给大家举几个例子,Millipore的ReBlot,Pierce的 Restore。大家还可以在网上搜到更多,通过比较,一定能找到适合自己实验的抗体剥离缓冲液的!

剥离技术的介绍就结束啦,希望对大家有用。在接下来的文章中,小编会跟大家说说在剥离之前的一些注意事项,敬请期待!
图片来自网络,内容由BioEngX原创,转载请注明!








order generic zovirax 400mg – zovirax us rosuvastatin 10mg without prescription
misoprostol 200mcg cheap – buy misoprostol without prescription buy diltiazem cheap
brand desloratadine – dapoxetine canada priligy 90mg usa
Pretty! This was an incredibly wonderful article. Many thanks for providing this info.
I like this website so much, saved to my bookmarks.
semaglutide 14 mg us – order vardenafil 10mg online periactin 4 mg cost
augmentin 1000mg cost – duloxetine 20mg generic oral duloxetine 20mg
My brother recommended I would possibly like this website. He was entirely right. This publish actually made my day. You can not consider simply how a lot time I had spent for this info! Thanks!
[url=https://otodetay.net/uncategorized/explore-opportunities-dafa-bet-thrilling-betting-options.html]otodetay.net[/url]
гѓ—гѓ¬гѓ‰гѓ‹гѓі гЃЇйЂљиІ©гЃ§гЃ®иіј – г‚ёг‚№гѓгѓћгѓѓг‚ЇйЊ 500mg еј·гЃ• г‚ёг‚№гѓгѓћгѓѓг‚Ї еЂ¤ж®µ
バイアグラジェネリック йЂљиІ© – シルデナフィルジェネリック йЂљиІ© г‚·г‚ўгѓЄг‚№гЃ®иіје…Ґ
Many thanks. I enjoy it.
ceske online casino online casino no deposit bonus golden crown casino online login
losartan 50mg us – order losartan sale cephalexin over the counter
Very well voiced of course! !
automatic payout online casinos usa online casino with real money best online casino arizona
Thank you, I like it.
juegos de casino online mexico best canadian online casino online lotto casinos
Great facts. Regards!
gta online casino heist how to get diamonds online casino for real money usa bandar taruhan casino cbet online
Cheers, Loads of advice.
best online casino georgia casino slots online free online casino slots no deposit
With thanks! Quite a lot of tips.
online parx casino online usa casinos bandar casino slot joker123 online
Amazing quite a lot of beneficial info!
casino online legal portugal online casino slot machines for real money online casino accepting skrill
Amazing a lot of fantastic information!
online casino management courses us casinos online best real money online casinos usa
Truly all kinds of terrific tips.
nj mgm online casino online real money casino usa juego casino online
Awesome content. Thank you!
neosurf australia online casino best casinos in canada online casino no deposit bonus 2017
buy generic augmentin 625mg – augmentin price buy levothyroxine medication
You have made the point!
what is the best online casino in canada no deposit casino bonus canada online casino minimum deposit $5
Terrific stuff, Thanks a lot.
lightning casino online casino online usa real money wildcard city online casino
You actually revealed that wonderfully!
online casinos that accept ltc real cash casinos online novomatic online casino deutschland
Beneficial advice. Cheers.
free online casino poker online casino bonus codes 100 promo online casino code
You actually expressed this effectively!
online casinos down best casino online canada online casino pay by phone bill
You actually mentioned this adequately.
casino online lt free casino games online gta online casino heist bug
Thank you, I like it.
bandar taruhan casino roulette online new online casinos usa real money online casino usa real money no deposit bonus codes
Tips very well considered.!
beste online casino mit sofortauszahlung online casino sites casino royale novel online
Awesome posts. Thanks.
casino royale juegos gratis online tragamonedas casino online bonus online casino free 200
Thanks a lot, A good amount of knowledge.
free online casino game best online casino canada online. casino
Cheers! Awesome information!
nuovi casino online best casinos for online slot machines real cash casino slots online
Many thanks! Excellent information!
holland online casino slot machines best usa online casino australian online casinos neosurf
“I don’t wanna jack-off, dad.” He says flabbergasted to his dad as he turns off the tap to the hot and chilly water in the shower.
Nicely put, Thank you.
schleswig holstein online casino free play online casino are online casino bonuses worth it
Awesome posts. Appreciate it.
roo casino online best online casino slots which pa online casino has the best payouts
buy betnovate 20 gm sale – buy generic monobenzone over the counter purchase monobenzone cream
Fantastic knowledge. With thanks.
clubwpt online poker casino spin casino canada best online casino costa rica
“You have not fucked, have you, my son? Have you?” His father asks, as he readjusts the cock covered and swelling in his khaki pants. “I thought as much.” Garrett thinks to himself; he did not wear a jock home from practice. He was ‘going commando.” Is it his older brother’s jock? “Oh, well. “He mumbles to himself as he takes another whiff of the musky scented pouch of the jock.
“Last I measured, I was nearly eight inches, dad. Maybe more. I may be even bigger, who knows.” He answers nonchalantly. “Yes, sir.” He says as he straightens up, standing erect as his member pulses to life between his legs, and in his father’s right hand, which are firmly locked on his balls. “Yes, sir, I do.”
prednisone 20mg us – prednisone 10mg over the counter purchase elimite online cheap
“Maybe his dad is right.” He thinks to himself as he continues with his intense fondling of his fiery red cock. He runs the towel through his curl-filled hair, and down over his chest, where the early signs of his manhood sprout like an uneven crop of hairs across his chest that run down to his furry-pillowed crotch. Where the throbbing from his hard-on springs back as the damp towel whips his erection back and forth with each swipe of the now dampened towel.
Information well regarded!.
all star casino online [url=https://usagamblinghub.com/#]casino online games free[/url] best 2019 australian online casino
“What ya lifting now?” His dad asks as he fidgets on the commode seat. He can feel his hard-on growing in his pants. gay sex porn “It was intense. Really intense. We ran so many drills. I am exhausted.” He explains.
order isotretinoin 10mg without prescription – order deltasone 5mg pills order deltasone pills
order omnicef 300 mg online – buy clindamycin without a prescription clindamycin oral
Incredible lots of terrific knowledge.
online casino real money blackjack casino bonus online australian online casino min deposit $10
Nicely put, Many thanks!
donkey kong online casino login free casino online casino online francais
Amazing tons of superb tips.
online casino bonus blog casino gambling online jb online casino
Thanks. A lot of material!
free casino games online to play without downloading online casino free spins no deposit no deposit win real money online casino
You revealed that very well.
vegas casino online bonus codes 2020 [url=https://usagamblinghub.com/#]newest online casinos usa[/url] choi casino online
You reported it superbly!
xgames online casino live casino online online casino lithuania
With thanks. Excellent information!
australian online casino no deposit bonus play casino online free bandar casino online terpercaya
Nicely put. With thanks!
777 lucky slots online casino best casinos online pa online casino paypal
Wonderful write ups. Regards!
gta online casino keypad usa casino online agent 007 casino royale online subtitrat
Nicely put, Appreciate it!
casino online 100 bonus play casino online free best cashtocode online casino
Nicely put, Regards!
best online casino sign up bonus no deposit online gambling casino casino online baku
Amazing posts. Thanks.
betmgm online casino pa best usa online casinos bally’s casino online application
artane order – diclofenac gel where to purchase order voltaren gel online cheap
Really plenty of awesome tips!
casino royale online casino casino games online online casinos in wv
You actually suggested that superbly.
mystic lake online casino no deposit online casino usa online casino free spins no deposit uk
You said it superbly.
best british online casinos casino online usa fargo online casino
Cheers, A lot of stuff!
fast paying online casinos popular online casinos gaming lounge online casino
Amazing material. Cheers.
turkey casino online casino online bonus alea online casino
Regards. I appreciate it.
gta 5 online casino heist payouts no deposit bonus online casinos most secure online casino
You actually revealed that exceptionally well!
online casino bonanza new online casino no deposit bonus betmgm online casino states
Tips very well considered.!
orionstars online casino new online casino usa ok ae casino online malaysia
Thanks, Helpful stuff.
yukon gold online casino canada online casino live playtech online casinos schweiz
You stated it superbly!
a list online casinos new online casinos for usa online casino welcome offer
Nicely put. Cheers!
online casino book [url=https://usagamblinghub.com/#]usa casino online[/url] free online casino games canada
Good postings, With thanks.
game online casino real money online casinos no deposit bonus 10 top uk online casinos
Kudos! I enjoy this.
how to report online casino online casino bonus gta 5 online casino penthouses
You actually said it wonderfully!
best online casinos for australian players [url=https://uscasinoguides.com/#]best usa online casino[/url] mohegan sun online casino connecticut
Whoa a good deal of amazing facts!
online casino fast withdrawal uk best usa online casinos 10 beste online casinos
You actually revealed this perfectly.
bonus casino online senza deposito [url=https://usagamblinghub.com/#]best usa online casinos[/url] online casino texas
Position well applied.!
are online casinos bogus best online casino mentor online casino bc canada
Many thanks. Very good information.
unibet online casino pa casino online bonus lucky star online casino real money
Wonderful facts. Regards.
atlantic city online casino online casino games $5 deposit online casinos
Appreciate it, Quite a lot of content!
pa online casino free sign up bonus best online casino sign up bonus gta online casino heist best crew
With thanks, Ample tips.
the meadows casino online [url=https://uscasinoguides.com/#]new online casino[/url] top online casino 2021
Perfectly voiced truly! .
supersport online casino free play online casino best online casino sites reviews
Nicely put. Regards!
casino online fr [url=https://usaplayerscasino.com/#]online american casinos[/url] best aus online casino
Perfectly spoken of course. .
big win casino online real money casino online gambling real online casino slots usa
Info well taken..
jilibet online casino online us casinos zeus online casino
Wow all kinds of very good tips!
norges beste online casino online usa casinos list of online casinos usa
mobic pills – mobic 15mg pills buy ketorolac generic
What computer does the revenge of the fallen game work well on?
https://offcourse.co/users/profile/john-leer
Lovely information. Thanks a lot!
online casinos netherlands https://uscasinoguides.com/superbowl-betting/ avis cresus online casino
Whoa tons of awesome info!
top online casinos michigan https://luckyusaplay.com/real-money-casinos/ online casino coins
This is nicely expressed! .
casino online europa https://luckyusaplay.com/legit-casinos/ cabaret club online casino
You revealed that superbly.
sabotage casino gta online https://usaplayerscasino.com/poker-apps/ best online casino russia
Awesome postings. Many thanks.
online gaming casino hiring https://uscasinoguides.com/nba-betting/ online casino no bonus codes
You actually mentioned it fantastically!
juegos casino online argentina https://usacasinomaster.com/real-money-baccarat/ slots of fortune online casino
Fantastic forum posts. Thank you.
new online casinos usa players https://usaplayerscasino.com/slotocash-review/ forbes casino online
order baclofen sale – buy lioresal generic buy feldene 20mg generic
Valuable knowledge. Kudos!
book of ra casino online https://usaplayerscasino.com/texas-casinos/ fruit shop online casino
Truly all kinds of valuable knowledge.
best online casinos with paysafecard https://uscasinoguides.com best casino online canada zodiac
Very good data. Kudos!
wynn bet online casino https://usagamblinghub.com/crash-games/ best online live casino india
Nicely put, Regards!
best rated online casino usa https://usagamblinghub.com/legit-casinos/ usa no deposit online casinos
Wonderful information. Thanks a lot!
mejor casino online usa https://usagamblinghub.com/superbowl-betting/ pokies online casino australia
cheap voveran sale – diclofenac tablets nimodipine cost
Great tips. Appreciate it!
titan casino online https://usagamblinghub.com/pennsylvania-casinos/ real money online casino nz
Helpful stuff. Thanks a lot.
online casino no verification withdrawal uk https://uscasinoguides.com/ignition-review/ grand casino online roulette
Thanks a lot! I enjoy it.
what online casinos accept credit cards https://usagamblinghub.com/boxing-betting/ bestes merkur online casino
Wow a lot of very good information!
new online casino pa 2022 https://uscasinoguides.com/cricket-betting/ list of safe online casinos
Kudos! I value it.
https://usagamblinghub.com/safe-casinos/
mestinon 60mg without prescription – pyridostigmine 60 mg us cheap azathioprine 50mg
I wanna start a website about fantasy sports. I have lots of ideas for content..
https://demo.socialengine.com/profile/htnweb333
buy rumalaya – amitriptyline pill buy endep sale
Beneficial write ups. Thanks a lot!
https://uscasinoguides.com/no-deposit-casinos/
How I Can make my article copyright marked?Who is authorized agency for copyright articles?
https://hearthis.at/htnweb/d-drill/
generic voltaren – purchase aspirin without prescription aspirin generic
I got good info from your blog
https://youtu.be/zKl96YeFZYw
As a Newbie, I am always exploring online for articles that can aid me. Thank you
https://www.d8austin.com/delta-11-thc
You got a very good website, Glad I observed it through yahoo.
https://youtu.be/MweGgJJqaFM
buy duphalac generic – buy generic brahmi over the counter betahistine 16 mg generic
cheap calcort for sale – calcort order online buy alphagan without a prescription
Some truly prize content on this website , bookmarked.
https://youtu.be/7lWBQ2KxDks
where to buy cyclosporine without a prescription – buy gloperba without prescription buy colchicine generic
Pretty great post. I simply stumbled upon your blog and wanted to say that I’ve truly enjoyed surfing around your weblog posts. In any case I’ll be subscribing to your feed and I’m hoping you write once more very soon!
https://youtu.be/_ICvZZ2rrx4
trileptal 600mg canada – trileptal 300mg without prescription levothyroxine pill
Very interesting topic, appreciate it for posting.
https://youtu.be/gnah3fbrjI8
I’d have to examine with you here. Which is not one thing I usually do! I take pleasure in reading a post that may make folks think. Additionally, thanks for permitting me to comment!
https://youtu.be/avjmlpkifoe
buy generic speman – order speman pills finasteride pills
hytrin 5mg drug – order hytrin 5mg generic buy generic priligy online
Nice read, I just passed this onto a colleague who was doing some research on that. And he just bought me lunch since I found it for him smile Therefore let me rephrase that: Thanks for lunch!
https://youtu.be/hYLjw4dIPc8
It’s really a nice and helpful piece of information. I am glad that you shared this helpful info with us. Please keep us up to date like this. Thanks for sharing.
https://youtu.be/VcnFTX_9418
cheap finasteride without prescription – sildenafil 100mg uk buy uroxatral 10mg generic
If the share cropper stipulates that the seeds are the responsibility of the owner of the property that is not permitted because he has stipulated an outlay against the owner of the property cheapest place to buy cialis
Woah! I’m really enjoying the template/theme of this site. It’s simple, yet effective. A lot of times it’s hard to get that “perfect balance” between usability and visual appeal. I must say that you’ve done a great job with this. Additionally, the blog loads very quick for me on Firefox. Excellent Blog!
https://youtu.be/ihHIPQC87V8
buy noroxin generic – cheap flutamide generic confido order online
lasuna without prescription – order generic lasuna brand himcolin
cheap atorvastatin pill – purchase atorlip generic order bystolic online cheap
cheap gasex – cheap ashwagandha sale diabecon online buy
tenormin order – atenolol 50mg usa buy carvedilol generic
I enjoy your piece of work, thankyou for all the informative blog posts.
https://youtu.be/q3pQqJH2ZCI
where can i buy calan – cost diovan 160mg cheap tenoretic without prescription
Good – I should definitely pronounce, impressed with your site. I had no trouble navigating through all the tabs and related information ended up being truly easy to do to access. I recently found what I hoped for before you know it in the least. Quite unusual. Is likely to appreciate it for those who add forums or something, web site theme . a tones way for your client to communicate. Nice task.
https://youtu.be/o3u5PynI70U
buy minoxidil generic – order generic proscar finpecia without prescription
order durex gel – order durex gel how to get xalatan without a prescription
I am not very superb with English but I get hold this really leisurely to read .
https://www.revtut.com/
ondansetron 4mg cheap – oxytrol drug order requip 1mg online cheap
order ascorbic acid online cheap – ferrous 100mg pills compro for sale
buy generic cyclophosphamide – buy generic dimenhydrinate order trimetazidine generic
I appreciate, cause I found exactly what I was looking for. You’ve ended my 4 day long hunt! God Bless you man. Have a great day. Bye
https://youtu.be/E1Ovh9KKmoU
aldactone 100mg sale – buy epitol generic naltrexone without prescription
buy cheap depakote – buy amiodarone paypal order topiramate 200mg online
Hello! I could have sworn I’ve been to this blog before but after browsing through some of the post I realized it’s new to me. Anyways, I’m definitely happy I found it and I’ll be book-marking and checking back frequently!
https://youtu.be/mvxymB2-4zQ
I’m not that much of a online reader to be honest but your blogs really nice, keep it up! I’ll go ahead and bookmark your website to come back later. Many thanks
https://youtu.be/QT2yg-8bAuQ
Magnificent site. Lots of helpful info here. I¦m sending it to some pals ans additionally sharing in delicious. And certainly, thank you to your effort!
https://www.xiepa.com/contact/
nootropil 800 mg brand – buy nootropil 800mg pills sinemet online
I am extremely inspired with your writing talents as well as with the format on your weblog. Is that this a paid topic or did you modify it your self? Anyway keep up the excellent quality writing, it is uncommon to see a great blog like this one these days..
https://youtu.be/R8y87InqeE8
purchase piroxicam – buy rivastigmine 6mg exelon buy online
etodolac 600mg tablet – order monograph 600 mg generic cilostazol without prescription
order enalapril 5mg pills – latanoprost generic xalatan price
dramamine 50mg brand – actonel 35 mg ca purchase actonel for sale
forxiga 10mg price – order forxiga 10mg generic cost acarbose
There is obviously a lot to know about this. I feel you made certain nice points in features also.
https://youtu.be/e7zZpabc8Pg
cheap griseofulvin 250 mg – dipyridamole oral where can i buy gemfibrozil
bactrim 960mg generic – buy generic levetiracetam over the counter tobra sale
buy eukroma cream for sale – order duphaston generic order dydrogesterone
ahWzEjUn
dulcolax 5 mg sale – imodium price buy liv52 20mg pill
order aciphex 20mg – metoclopramide 20mg pill buy generic motilium online
fludrocortisone cheer – protonix shed prevacid area
Having read this I thought it was very informative. I appreciate you taking the time and effort to put this article together. I once again find myself spending way to much time both reading and commenting. But so what, it was still worth it!
http://www.tlovertonet.com/
clarithromycin pills terrify – cytotec pills reasonable cytotec pills attract
promethazine smash – promethazine stool promethazine endless
loratadine heap – loratadine mountain claritin brown
dapoxetine soon – dapoxetine gloomy priligy often
claritin pills rumble – claritin pills small claritin pills trace
uti medication wrong – uti treatment rent treatment for uti woman
prostatitis pills despair – prostatitis treatment serious pills for treat prostatitis perceive
asthma medication sake – asthma medication switch inhalers for asthma entrance
cenforce water – cialis coupon brand viagra online connection
priligy bird – suhagra thief cialis with dapoxetine northern
cialis soft tabs pills door – cialis soft tabs rusty viagra oral jelly blank
cialis soft tabs pills fate – cialis oral jelly pills squat viagra oral jelly online horn
cenforce online keep – brand viagra pills acquaint
brand cialis tone – forzest leg penisole wild
buy viagra professional jane – viagra gold horn levitra oral jelly quarter
dapoxetine lick – viagra plus favourite cialis with dapoxetine camp
crestor online mud – pravastatin online troop caduet otherwise
purchase nitroglycerin generic – order generic valsartan 160mg valsartan 160mg uk
simvastatin represent – zocor dot lipitor reach
order hydrochlorothiazide 25 mg generic – buy generic norvasc purchase zebeta online
digoxin 250 mg price – buy generic labetalol 100 mg furosemide 40mg pill
generic nizoral – cost nizoral order itraconazole 100 mg online
famciclovir 250mg uk – order valcivir 500mg generic buy cheap valaciclovir
lamisil 250mg brand – buy grifulvin v generic griseofulvin oral
purchase rybelsus without prescription – order DDAVP online generic desmopressin
buy cheap generic micronase – buy glucotrol sale forxiga brand
desloratadine 5mg uk – buy ketotifen 1mg pills best allergy for itchy skin
medrol over counter – cheap montelukast 10mg order azelastine 10 ml for sale
ventolin inhalator online buy – fluticasone buy online buy theophylline pills
ivermectin 6mg over counter – buy cefaclor 500mg pill cefaclor online
cleocin 300mg us – buy vibra-tabs buy generic chloramphenicol
buy azithromycin without a prescription – tinidazole 500mg tablet buy ciprofloxacin generic
buy amoxil without a prescription – buy cefadroxil cheap cost ciprofloxacin 1000mg
purchase amoxiclav generic – septra over the counter order cipro 1000mg pills
order hydroxyzine 10mg generic – order fluoxetine sale buy endep 10mg online cheap
purchase seroquel generic – seroquel drug order eskalith online
purchase clomipramine generic – cymbalta tablet buy sinequan without prescription
buy zidovudine for sale – buy glucophage 500mg for sale zyloprim 300mg usa
order clozaril 50mg – buy amaryl no prescription oral famotidine 40mg
buy metformin 500mg online cheap – purchase metformin sale order lincomycin sale
buy furosemide 100mg generic – furosemide oral captopril 25mg usa
flagyl 200mg us – clindamycin tablet cost azithromycin 500mg
purchase ampicillin pill acticlate over the counter buy generic amoxil for sale
buy valacyclovir 1000mg without prescription – vermox order purchase zovirax generic
ivermectin 12mg oral – buy aczone pills sumycin for sale
order flagyl 400mg generic – order cefaclor 500mg sale azithromycin 500mg pills
buy ciprofloxacin – buy erythromycin generic erythromycin 250mg pills
ciprofloxacin 1000mg oral – buy ciprofloxacin 500mg pills order augmentin 1000mg sale
cipro 500mg cost – buy augmentin tablets clavulanate pills
buy lipitor 20mg buy lipitor without prescription order atorvastatin 10mg generic