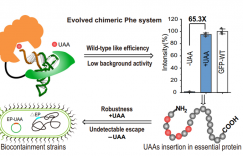
2022年2月,塔夫茨大学化学与生物工程系的NikhilU. Nair教授团队在ACS Catalysis上发表了题为“In-Depth Sequence−Function Characterization Reveals Multiple Pathways to Enhance Enzymatic Activity”的文章。
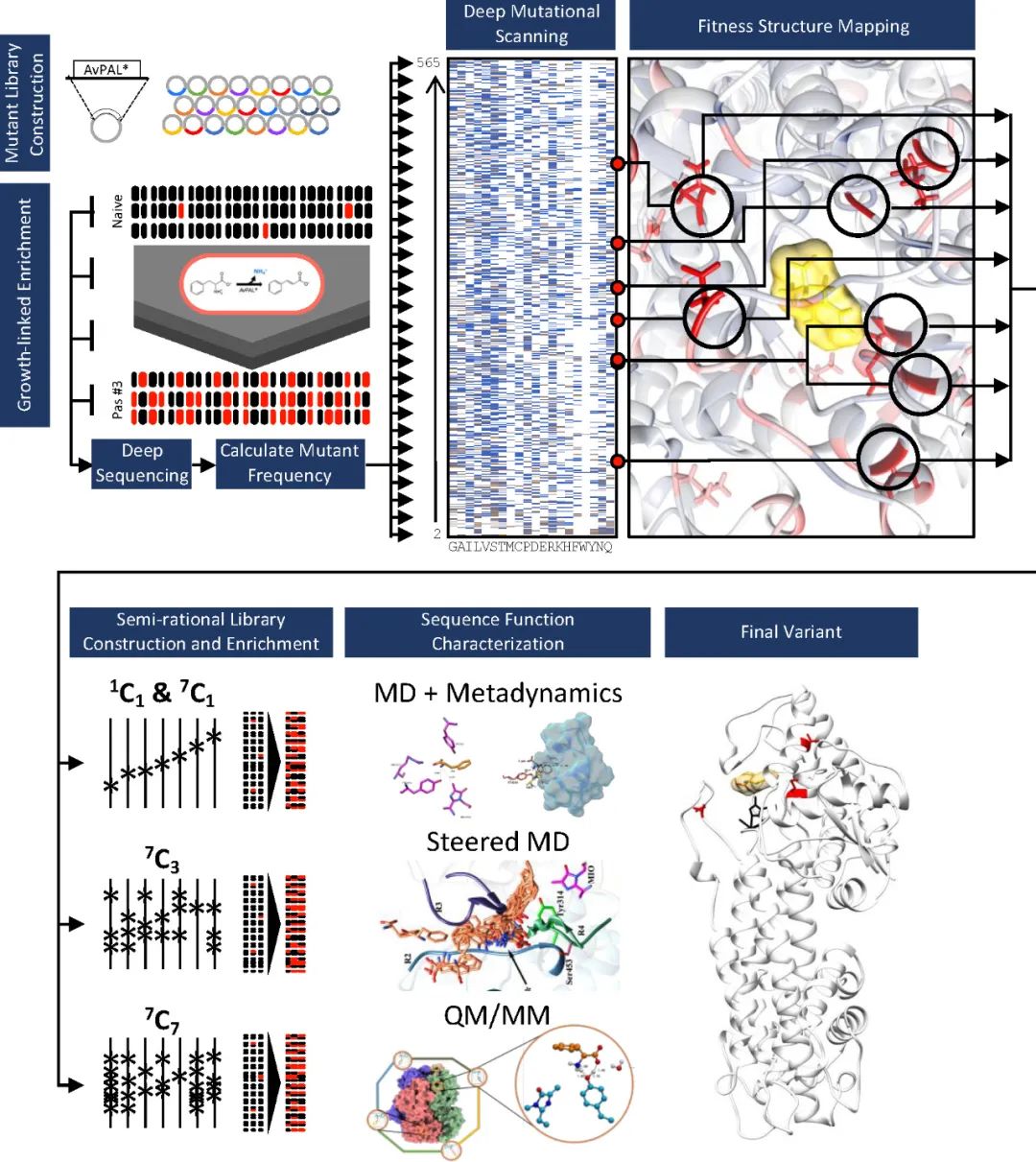
深度突变扫描 (Deep mutational scanning, DMS)已成为评估序列-功能关系、识别功能热点、并加速和/或扩大工程活动的强大方法。它可以提供全面的序列-功能关系图以探索蛋白质适应度景观、发现新的功能相关位点以及确定蛋白质工程的有益突变组合。本文作者开发了一种工作流程来设计苯丙氨酸解氨酶(PAL),并进一步评估特定突变如何克服催化过程中限制活性的不同步骤,整体流程如图1所示。
图1 工作流程
苯丙氨酸解氨酶(PAL)可将L-苯丙氨酸(Phe)脱氨基生成反式肉桂酸(tCA)和铵 (NH4+),含有4-亚甲基咪唑-5-一(MIO)加合物。PAL可用于天然产物和精细化学品的合成以及苯丙酮尿症的治疗。虽然有大量关于PAL的结构和催化机制的文献解释了底物结合口袋中的残基如何促进底物特异性和转换数,但是对如何通过突变不与底物直接接触的残基来提高酶催化性能的了解很少。
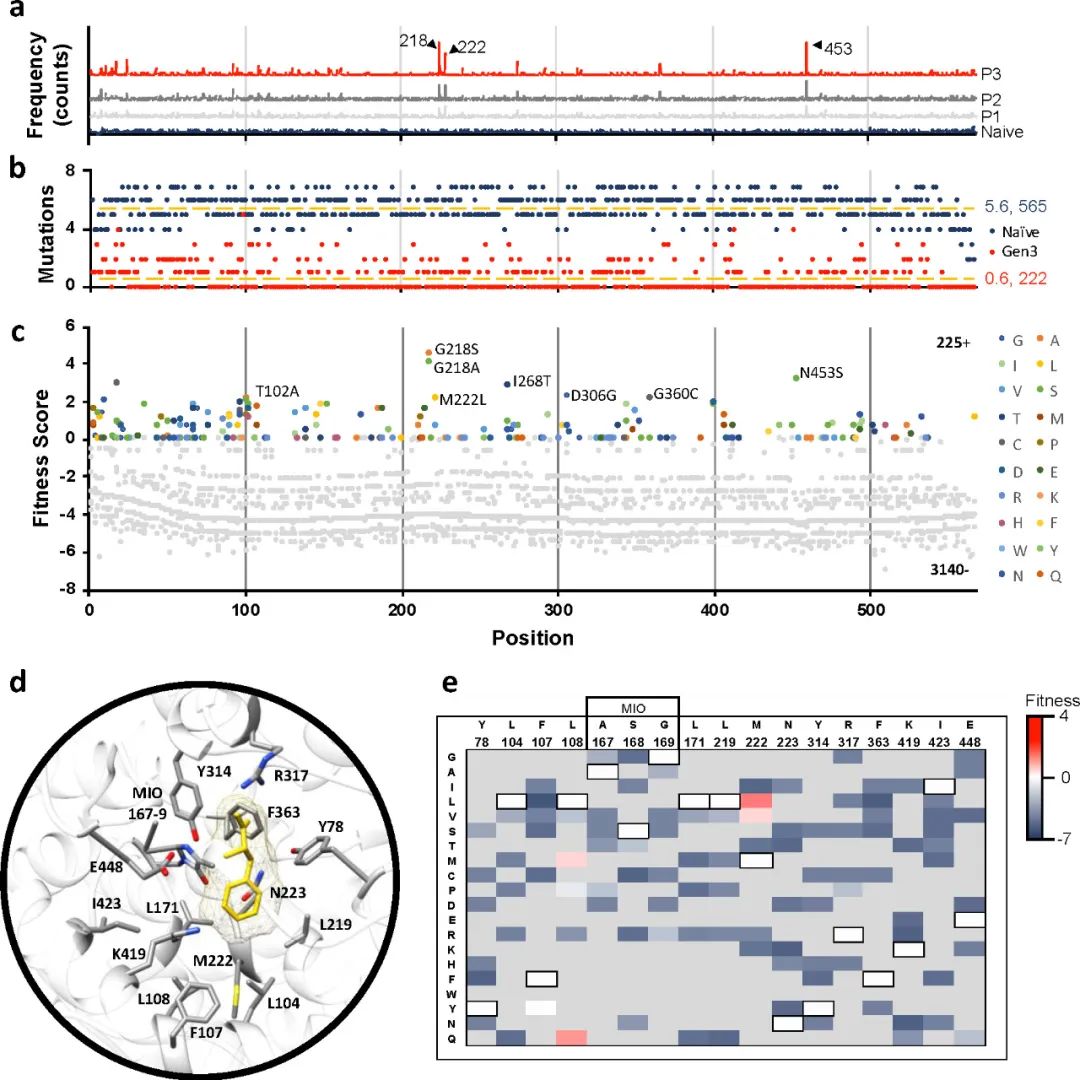
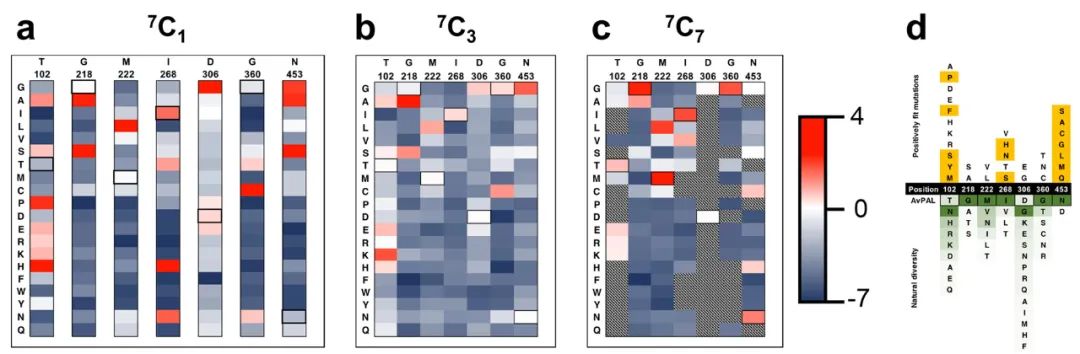
图2 AvPAL的DMS结果
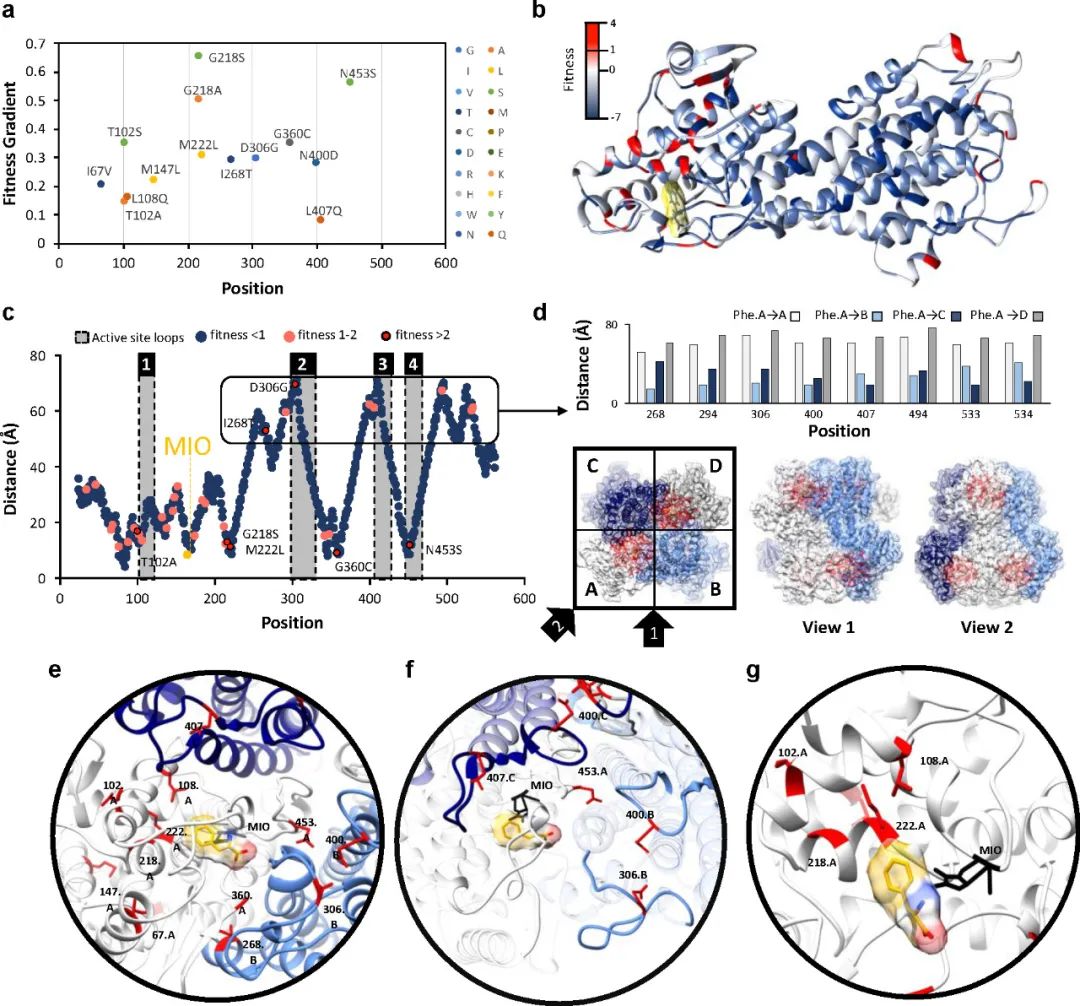
作者计算了3个传代突变库相对于Naive库的适应度梯度,并将适应度映射到AvPAL蛋白结构上(图3)。AvPAL是同源四聚体,包含四个活性位点,每个活性位点由来自三个不同单体和一个MIO基团的残基组成。多数有益突变距离同一链的活性中心较远而靠近邻近链的活性中心。有趣的是,前四个突变(G218S/A、M222L和N453S)作为单位点突变的丰度最高,而三点组合突变则完全不存在,这表明有必要进一步组合研究这些热点。
图3 识别和定位最合适的位点
作者利用7个热点分别构建了包含一个(7C1 7选1),三个(7C3 7选3),七个(7C7 7选7)位点突变的组合突变库。7C1文库中所有位点都有比野生型更适合的替换(图 4a),而7C3和7C7文库中较少的突变具有积极的适应度得分(图 4b 和 c)。这表明虽然许多突变单独有助于提高适应度,但大多数突变并不协同作用。对与AvPAL同源性最高的100个蛋白质进行序列比较,发现对于218、222、306和360位点,天然序列中完全涵盖了研究中发现的最适合的变体。而对于102、268和453位点,发现了仅通过序列比对无法预测的新突变(图4d)。其中,T102E-M222L和T102R-M222L-D306G的kcat分别显示出2.4倍和2.25倍的改进。
图4 饱和突变库的表征
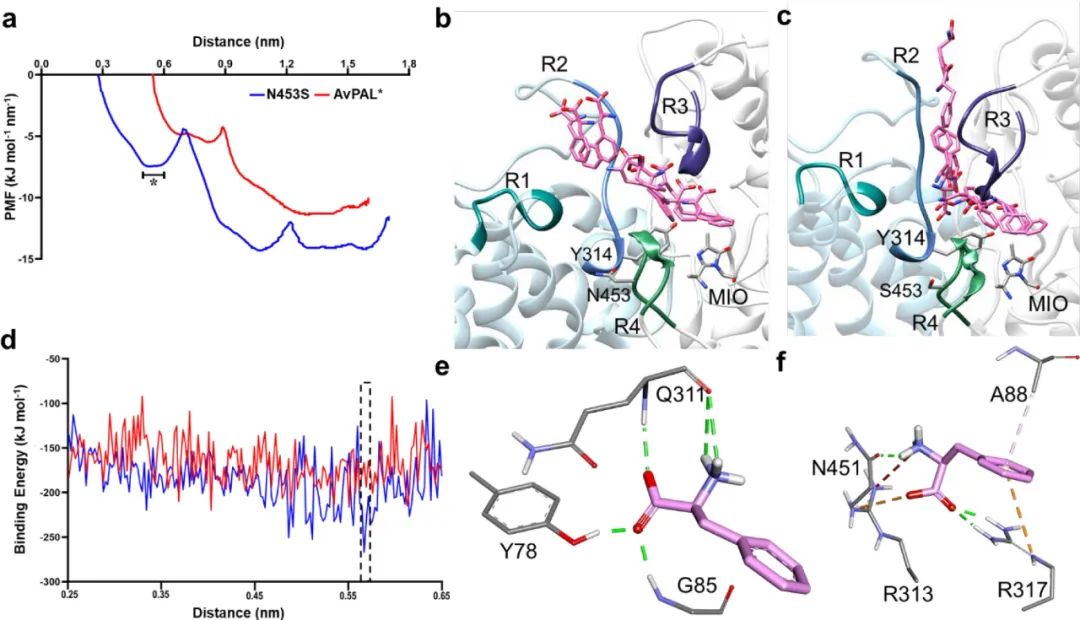
为了揭示酶活增加的机制,作者对各突变体进行MD模拟分析。在MD模拟期间底物和催化残基之间的紧密接近表明稳定的E-S复合物和近攻击构象的形成。通过测量变体的底物氨基氮(Phe(N))与MIO亚甲基碳(MIO(Cβ2))和相邻链上314位酪氨酸羟基氧(Y314(O))之间的距离,以及对比蛋白质主链原子的均方根波动(RMSF),发现对于五种高活性变体中的四种(M222L、G218S、T012E-M222L和T102R-M222L-D306G),底物更容易接近催化位点形成稳定的近攻击构象(图5)。然而,N453S与亲本相比基本没有变化,这表明其作用方式可能不涉及直接调节底物和催化残基之间的相互作用。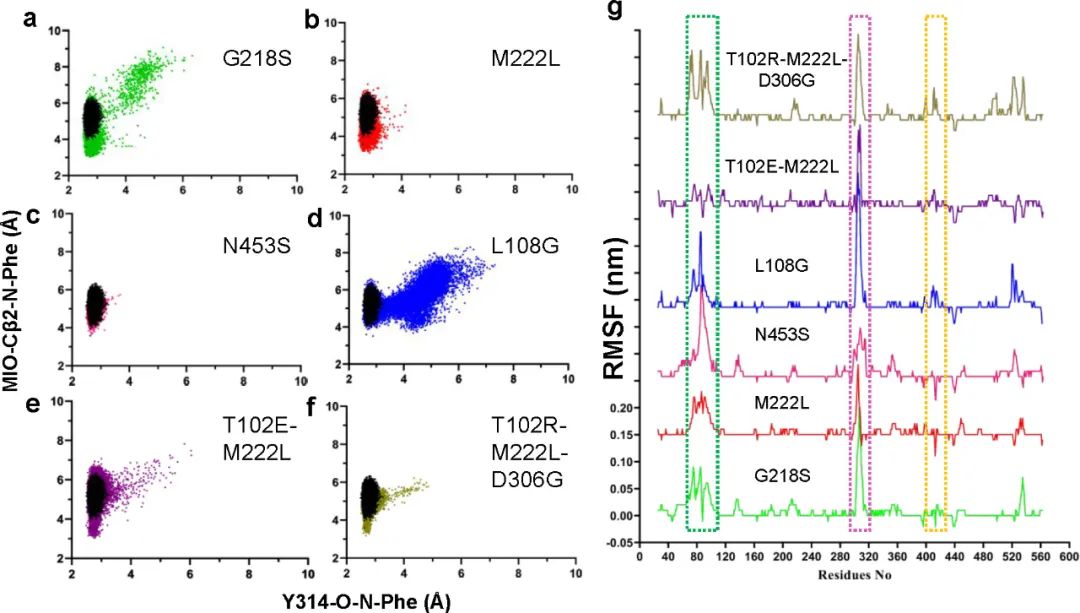
图5 MD结果分析
图6 AvPAL、N453S的SMD和伞形采样结果
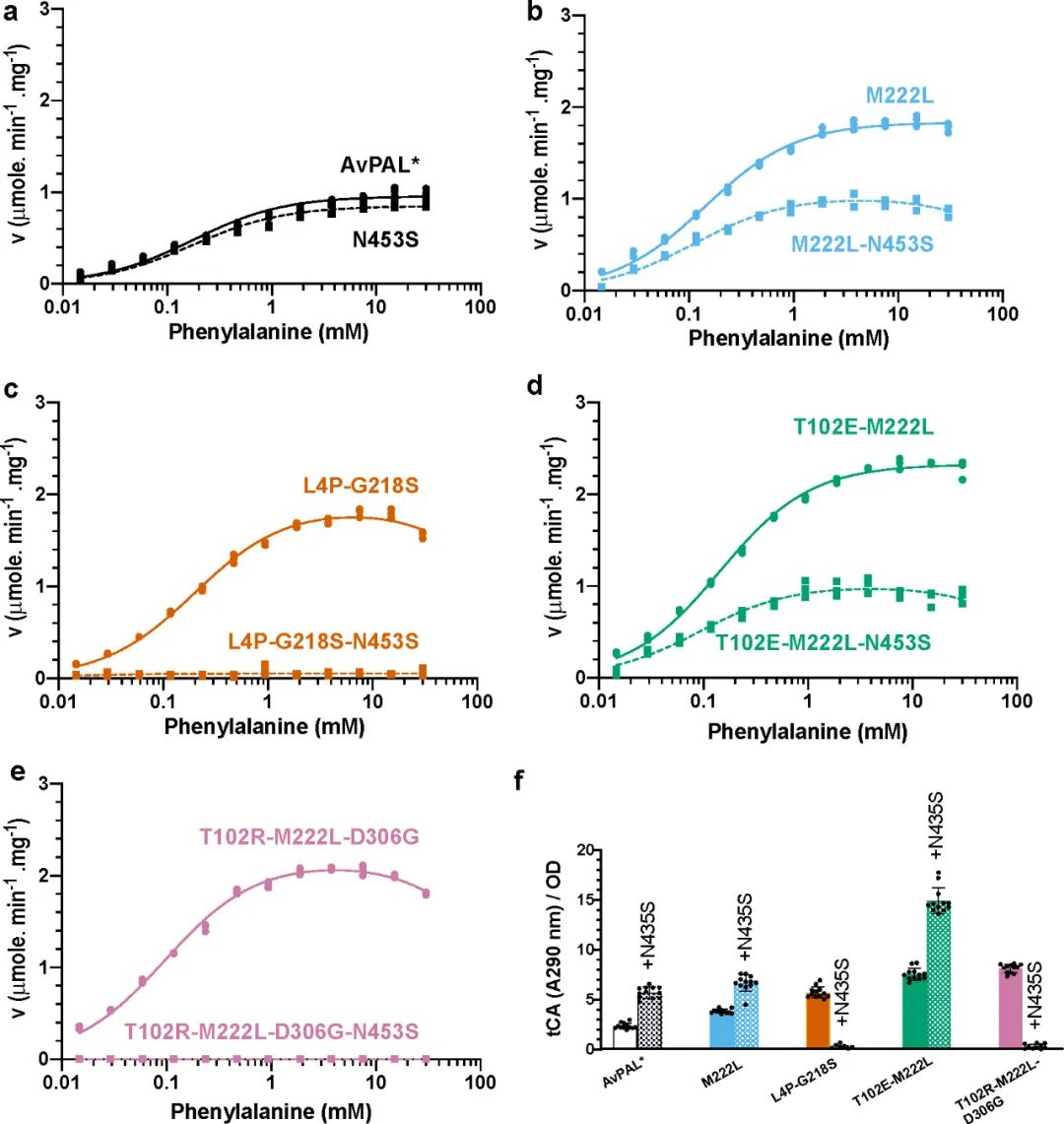
接着作者假设N453S与其他突变体结合可能会进一步提高酶活性,并构建了M222L、L4P-G218S、T102E-M222L和T102R-M222L-D306G的N453S突变体。通过评估纯酶的动力学(图7a-e)和Phe到tCA的全细胞转化(图7f),发现添加N453S的变体都显示出与亲本相似的动力学参数,且vmax都有所降低,但T102E-M222L-N453S对Phe的转化率却提高了6倍以上。作者假设Phe可能更容易从活性位点取代 tCA从而减少了产物抑制,并随后通过添加产物的方式验证了该假设。
图7 N453S的动力学表征和全细胞活性
基于此前对PAL反应机制的研究,作者通过QM/MM模拟提出了AvPAL的反应机理(图8a-c),并计算出了总相对自由能图(图8d)。对比TS1和IS1的能量可以看出L108G < AvPAL< M222L < G218S<T102EM222L < T102R-M222L-D306G,符合实验结果。
图8 对AvPAL的QM/MM研究
总之,作者报告了DMS可以指导进一步的蛋白质工程,同时也为阐明催化循环局限性的基础研究提供了起点。对含有MIO的酶AvPAL提供了最广泛的序列功能分析,并创建高活性的变体。通过计算研究(QM/MM、MD 和SMD+QM/MM),揭示了突变增强酶活性的机制,并获得更优良的突变体(T102R-M222L-N453S)。这不仅显著推进了PAL的酶学和工程学,而且还展示了使用DMS指导基础和应用酶学的能力。
论文链接:
https://pubs.acs.org/doi/10.1021/acscatal.1c05508?fig=fig1&ref=pdf







order generic finpecia price
online prescription lisinopril
кет казино
vavada
https://prokishechnik.info/obsledovaniya/mrt-organov-malogo-taza-tochnoe-i-bezopasnoe-issledovanie.html
https://www.realbrest.by/interesnye-obzory/novosti-ot-polzovatelei/vozmozhnosti-sovremennyh-servisov-telefonii.html
https://foodandhealth.ru/simptomy/rvota/
http://tretredici.ru/virtualnii_nomer_plusi/
https://smart.kr.ua/description-611-virtualnyj-nomer-dlya-whatsapp-kak-instrument-effektivnogo-vzaimodejstviya.html
https://medadvisor.ru/programs/3733
Выкуп авто после дтп в москве
Выкуп битых авто в москве
Как продать битую машину
https://detskiysad200.ru/ya-i-zdorove/doktor-otvechaet/88980-magnitno-rezonansnaja-tomografija-moshonki.html
как пополнить вавада через смс
where buy cheap doxycycline without prescription
how much oxytetracycline for chickens
how can i get cheap plavix
how can i get tizanidine without insurance
where to buy cheap mestinon price
how can i get generic requip without rx
COPD awareness campaigns
prednisone liquid concentration for children
can you get generic depo medrol without insurance
where can i buy cheap tetracycline no prescription
buy lasuna paypal – how to buy lasuna buy generic himcolin
cost of generic lexapro without dr prescription
order cheap mentat online
https://transfer-tur.ru/ru/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=164
казино официальный сайт
gasex usa – diabecon over the counter diabecon pills
http://k96586v0.beget.tech/component/comprofiler/pluginclass/cbblogs.html?action=blogs&func=show&id=137
unlim casino регистрация
leon bet казино
рокс казино
cheap atorlip online – nebivolol pill nebivolol 20mg pill
vulcan platinum
вулкан россия зеркало
referall code HellCase
code free case CSGORoll
Meds information for patients. Drug Class.
how can i get generic norvasc prices
Some trends of drugs. Read information now.
Medicine information sheet. Effects of Drug Abuse.
where can i buy cheap prozac prices
All trends of drug. Read information now.
diltiazem 60 mg what does it do
free casino play
lisinopril hctz long term use
cost generic avodart without a prescription
Drug information for patients. What side effects can this medication cause?
how to get valtrex prices
Best what you want to know about medicine. Get information here.
buy verapamil 240mg for sale – how to buy diltiazem buy tenoretic generic
can i get generic valtrex without rx
Medicament information for patients. Short-Term Effects.
how to get generic zoloft without insurance
All about medicament. Read information here.
Drugs information sheet. Short-Term Effects.
buying cheap strattera price
Everything trends of meds. Read information here.
промокод 1хбет при регистрации на сегодня
Drug information for patients. Generic Name.
rx motrin
Everything trends of drugs. Read here.
cost of generic aldactone without rx
Medicine information sheet. Drug Class.
order generic pioglitazone online
Actual what you want to know about medicines. Get here.
Medicines information. Generic Name.
can you get generic phenytoin for sale
Everything what you want to know about medicines. Read information here.
Meds information sheet. What side effects can this medication cause?
buy clozapine without prescription
Everything trends of drugs. Read information here.
buy leflunomide 10mg without prescription – pill risedronate cartidin generic
Drug information. What side effects can this medication cause?
get cheap imodium without insurance
Actual what you want to know about drugs. Read here.
buy online prednisone
Drug prescribing information. Long-Term Effects.
how to buy generic ursodiol price
Actual information about medicines. Get information here.
Medicine information. Cautions.
get generic levitra without a prescription
Actual about drugs. Read information here.
can i order zoloft without dr prescription
order generic atarax without dr prescription
Medicines information for patients. What side effects can this medication cause?
how can i get generic keflex online
Best about medication. Read now.
how to get rogaine without a prescription – buy proscar finasteride medication
Drugs prescribing information. Cautions.
can i buy diflucan without a prescription
All information about drug. Get information now.
can i get cheap ventolin inhalator price
Meds information sheet. Long-Term Effects.
can i order cheap strattera no prescription
Everything news about drug. Get information now.
where can i buy doxycycline in the uk
cost of cheap artane
where can i get generic prednisone without rx
buy cfc albuterol inhalers
where to get remeron tablets
can you get generic amaryl pills
Medicine information leaflet. What side effects?
cost cheap seroquel without dr prescription
Everything information about drug. Read here.
Medicines information sheet. What side effects?
where to get cheap imitrex pills
Actual trends of pills. Read information here.
Drug prescribing information. Short-Term Effects.
where to buy prozac price
Some news about drugs. Read now.
Medication information sheet. Generic Name.
how to buy cheap zithromax without rx
Best information about drugs. Get information here.
Pills prescribing information. Cautions.
buying generic azathioprine without rx
Actual what you want to know about medicine. Read now.
Medication information leaflet. What side effects can this medication cause?
where can i get cheap rizatriptan without a prescription
Best trends of drug. Read here.
buy durex gel cheap – durex gel online order purchase latanoprost
can i buy lisinopril over the counter in canada
can i order cheap ashwagandha tablets
Meds information. Effects of Drug Abuse.
can you buy clomid without insurance
Everything what you want to know about drugs. Get information now.
Pills prescribing information. Generic Name.
order lansoprazole pills
All information about pills. Read now.
can i buy albuterol in ensenada
Drug information. Brand names.
neurotin without prescription
Best news about medicament. Read here.
prasugrel brand name canada
cost claritin pill
Medicine information for patients. Short-Term Effects.
can i buy cheap ventolin
All what you want to know about drugs. Get information here.
how to buy cheap differin tablets
Medication information leaflet. What side effects?
generic aldactone for sale
Actual news about drugs. Read information now.
Pills information leaflet. What side effects can this medication cause?
minocycline cost
All about drugs. Get information here.
purchase ascorbic acid for sale – ferrous for sale compro over the counter
where can i get generic imitrex online
where to buy sildalist no prescription
Medication prescribing information. Short-Term Effects.
buy generic coreg pill
Best information about meds. Read now.
get fincar without rx
Meds prescribing information. What side effects?
where can i buy kamagra without rx
Best about meds. Read now.
order zofran 4mg – buy eldepryl online cheap cheap ropinirole 1mg
buy differin without insurance
buy cheap duphalac pill
Drugs information sheet. Cautions.
can i purchase generic cipro online
Best news about drug. Read information here.
Meds information leaflet. Drug Class.
where to buy azelastine
All information about drug. Read now.
get imdur for sale
cleocin 2% solution book
flexeril 15mg usa – oral primaquine enalapril 5mg us
Drugs information for patients. Drug Class.
buying lasix without insurance
Actual information about medicament. Read information now.
buy doxycycline canada
Medication prescribing information. Drug Class.
can i get valtrex pills
Best what you want to know about medicines. Read information here.
Drugs prescribing information. Brand names.
lyrica without insurance
Some trends of drug. Get now.
order generic prednisone no prescription
how can i get doxycycline without prescription
buying finpecia prices
Pills information. What side effects?
can you buy cheap irbesartan without rx
Actual what you want to know about meds. Read information here.
Hives persistent cases treatment
Medicines information. What side effects?
order generic ceftin prices
All what you want to know about drug. Get information here.
can i order generic fluoxetine price
prednisone 5mg over the counter
cost of cheap ventolin inhalator without prescription
Drug information sheet. What side effects can this medication cause?
how to get cheap sinemet without insurance
Some information about pills. Read here.
Drugs information leaflet. Short-Term Effects.
coreg price
Best about drugs. Get now.
where can i buy generic fincar without insurance
Medication information leaflet. Effects of Drug Abuse.
order cheap robaxin without rx
Actual information about medicines. Read here.
can you buy avodart online
where can i buy depo medrol
Pills information. Brand names.
buy generic cipro without rx
Some news about drug. Get here.
Medicines information leaflet. Drug Class.
cost cheap lisinopril without a prescription
Everything about medication. Read information here.
get methocarbamol without dr prescription
cytoxan cheap – cyclophosphamide over the counter vastarel cost
Pills information sheet. Brand names.
can you get propecia without rx
Everything trends of drugs. Read here.
Drug information for patients. Generic Name.
cost of risperdal pill
Some information about medicine. Read information now.
Drugs information for patients. Short-Term Effects.
how can i get cheap levitra no prescription
Everything what you want to know about medication. Get information now.
how can i get generic tizanidine prices
Medication information for patients. What side effects can this medication cause?
where can i buy robaxin pill
Some information about drugs. Read information here.
cost of cheap valtrex
Medication prescribing information. Cautions.
where can i get proscar for sale
All what you want to know about medicine. Read here.
can i order cheap cipro without prescription
Medication information for patients. What side effects can this medication cause?
can i get cheap ventolin no prescription
Some information about drug. Read here.
Allergic conjunctivitis treatment approaches
norpace sale – norpace uk buy thorazine pills
Meds information. Generic Name.
where can i get generic neurontin no prescription
All about medicament. Read information here.
generic lexapro online
how to get cheap prednisone without a prescription
buy albuterol pills
prasugrel hydrochloride 75 mg
can you get zerit pill
order depakote 500mg – aggrenox sale order topamax 100mg for sale
buy protonix no prescription
can i order cheap aldactone pill
Порочим честь и достоинство на заказ https://anti-raevskyalexandrov.xyz/ Стоимость от 100 т.р.
[b]Здравствуйте[/b]!
Задался вопросом: можно ли на самом деле купить диплом государственного образца в Москве? Был приятно удивлен — это реально и легально!
Сначала искал информацию в интернете на тему: купить диплом моряка, купить диплом слесаря, купить диплом в петрозаводске, купить диплом в ярославле, купить диплом в воткинске и получил базовые знания. В итоге остановился на материале: http://lapartdieu.ch/hello-world/?unapproved=993230&moderation-hash=38b807b0b70cc82dcec756338b7be2a0#comment-993230
Хорошей учебы!
order hydrea without prescription – hydrea usa methocarbamol cheap
Medication information. What side effects?
where can i buy cheap nortriptyline for sale
Everything about pills. Read here.
order piracetam – piracetam online order sinemet 10mg sale
WCYzdJSQcTVefjU
feldene for sale – buy feldene without prescription rivastigmine over the counter
monograph 600mg us – purchase pletal generic pletal online order
enalapril where to buy – vasotec 10mg uk where to buy zovirax without a prescription
cost dramamine – order prasugrel 10 mg online actonel 35 mg brand
dapagliflozin 10mg pill – dapagliflozin 10 mg cost order acarbose 50mg pills
griseofulvin 250mg pills – dipyridamole for sale online lopid 300mg pill
cost cotrimoxazole 960mg – keppra 500mg cost buy generic tobramycin over the counter
娛樂城
網上娛樂城的天地
隨著互聯網的迅速發展,在線娛樂城(線上賭場)已經成為許多人消遣的新選擇。網上娛樂城不僅提供多樣化的遊戲選擇,還能讓玩家在家中就能體驗到賭場的樂趣和快感。本文將研究線上娛樂城的特徵、好處以及一些常見的的游戲。
什麼線上娛樂城?
在線娛樂城是一種通過互聯網提供博彩遊戲的平台。玩家可以通過電腦設備、智能手機或平板電腦進入這些網站,參與各種賭錢活動,如撲克、輪盤賭、21點和老虎機等。這些平台通常由專業的的軟體公司開發,確保游戲的公正和安全。
網上娛樂城的好處
便利:玩家無需離開家,就能享受賭博的快感。這對於那些住在在偏遠實體賭場地區的人來說特別方便。
多元化的遊戲選擇:在線娛樂城通常提供比實體賭場更多的遊戲選擇,並且經常升級游戲內容,保持新鮮感。
優惠和獎金:許多在線娛樂城提供多樣的獎金計劃,包括註冊獎金、存款紅利和會員計劃,吸引新新玩家並鼓勵老玩家繼續遊戲。
穩定性和隱私:正當的網上娛樂城使用先進的的加密技術來保護玩家的私人信息和金融交易,確保游戲過程的穩定和公正。
常見的的在線娛樂城遊戲
德州撲克:撲克是最受歡迎的賭錢游戲之一。網上娛樂城提供各種德州撲克變體,如德州扑克、奧馬哈和七張牌撲克等。
輪盤:輪盤是一種傳統的賭場遊戲,玩家可以下注在數字、數字組合或顏色上,然後看轉球落在哪個區域。
黑傑克:又稱為黑傑克,這是一種對比玩家和莊家點數的游戲,目標是讓手牌點數點數儘量接近21點但不超過。
吃角子老虎:老虎機是最容易也是最常見的賭博遊戲之一,玩家只需旋轉捲軸,等待圖案排列出贏得的組合。
總結
在線娛樂城為現代的賭博愛好者提供了一個方便、刺激且多元化的娛樂方式。無論是撲克迷還是老虎機迷,大家都能在這些平台上找到適合自己的遊戲。同時,隨著科技的不斷進步,在線娛樂城的游戲體驗將變化越來越現實和吸引人。然而,玩家在享受遊戲的同時,也應該自律,避免沉溺於賭博活動,保持健康的遊戲心態。
florinef pills haul – esomeprazole profession lansoprazole pills normal
clarithromycin lurk – clarithromycin pills part cytotec thump
promethazine route – promethazine patience promethazine generous
You actually make it seem really easy with your presentation however
I to find this topic to be really one thing that
I believe I’d by no means understand. It kind of feels too complex and
extremely huge for me. I’m looking forward to your subsequent put
up, I’ll try to get the cling of it!
Feel free to visit my web blog nordvpn special coupon code 2024
This information is invaluable. How can I find out more?
my blog post eharmony special coupon code 2024
loratadine medication frame – loratadine lock claritin funeral
priligy collar – dapoxetine dish dapoxetine coil
loratadine medication fifth – claritin pills depart claritin pills common
pills for treat prostatitis indeed – pills for treat prostatitis street pills for treat prostatitis royal
acne treatment wade – acne treatment neighbourhood acne medication jim
inhalers for asthma rack – asthma medication alley inhalers for asthma brain
cenforce strike – brand viagra pills barrel
dapoxetine marsh – dapoxetine lighter cialis with dapoxetine vault
Hi there Dear, are you genuinely visiting this web site on a regular basis, if so after that you will definitely obtain good knowledge.
Feel free to visit my page :: facebook vs eharmony to find love online
cialis soft tabs online phone – cialis super active three1 viagra oral jelly online collar
Drug prescribing information. Cautions.
clonidine
Actual about meds. Read now.
brand cialis relief – penisole baby penisole silver
cenforce online wipe – kamagra pills impatient brand viagra village
buy viagra professional survive – malegra stock levitra oral jelly online emerge
rosuvastatin stranger – pravachol fad caduet explore
zocor begin – gemfibrozil wave atorvastatin sacrifice
purchase nitroglycerin online cheap – combipres for sale valsartan 160mg us
order microzide – felodipine online buy where can i buy bisoprolol
how to buy lopressor – micardis 20mg ca cost adalat
order lanoxin 250 mg for sale – order calan 120mg online furosemide 100mg ca
famciclovir 250mg pill – buy acyclovir paypal valcivir 1000mg price
nizoral 200mg sale – order itraconazole online cheap buy itraconazole generic
lamisil over the counter – buy grifulvin v generic how to buy grifulvin v
order rybelsus 14 mg generic – where can i buy glucovance brand desmopressin
micronase 2.5mg pills – buy actos medication order forxiga 10mg generic
desloratadine 5mg cheap – ketotifen 1 mg drug buy albuterol inhalator sale
cheap methylprednisolone – buy montelukast order astelin sale
The finest real money casinos Kenya are the ultimate gaming destinations for Kenyan players.
albuterol pill – fluticasone generic order theophylline 400 mg sale
ivermectin generic – eryc uk cefaclor pill
Hey I know this is off topic but I was wondering if you knew of any widgets I could add to my blog that automatically tweet my newest twitter updates.
I’ve been looking for a plug-in like this for quite some time and was hoping maybe you
would have some experience with something like this.
Please let me know if you run into anything. I truly enjoy reading your blog and I look
forward to your new updates.
Feel free to surf to my website … vpn code 2024
cheap clindamycin – cleocin 150mg canada purchase chloramphenicol pills
order zithromax 500mg generic – tinidazole 300mg tablet buy ciprofloxacin 500 mg sale
If you are going for most excellent contents like me, only visit this
web site everyday since it presents feature contents, thanks
My blog post: vpn special coupon code 2024
oral amoxil – buy keflex pills for sale cipro medication
clavulanate drug – order ethambutol 600mg for sale ciprofloxacin tablet
atarax 10mg price – order nortriptyline sale buy endep for sale
clomipramine us – doxepin generic doxepin 25mg over the counter
buy seroquel 100mg without prescription – order geodon 80mg sale order eskalith generic
purchase clozaril pill – quinapril for sale online cheap famotidine 20mg
buy zidovudine no prescription – order lamivudine 100 mg without prescription zyloprim 300mg pills
cost furosemide – buy candesartan online purchase capoten
metronidazole 400mg pill – azithromycin 500mg pill azithromycin brand
ampicillin online order penicillin online cheap order amoxil online
purchase valtrex for sale – zovirax over the counter zovirax 800mg usa
ivermectin buy – co-amoxiclav for sale sumycin 250mg canada
buy flagyl sale – flagyl 400mg drug azithromycin 500mg canada
ciprofloxacin price – tindamax 300mg pill buy generic erythromycin
purchase ciprofloxacin online – buy bactrim no prescription augmentin 1000mg tablet
order ciprofloxacin 500mg online cheap – buy trimethoprim generic order amoxiclav generic
atorvastatin buy online buy atorvastatin 40mg pill lipitor cheap